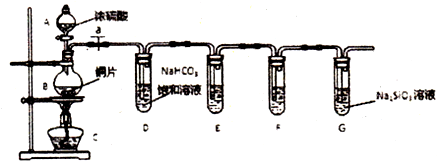
题目内容
13.下列关于浓HNO3与浓H2SO4的叙述正确的是( )| A. | 常温下都不可用铝制容器贮存 | |
| B. | 常温下都能与铜较快反应 | |
| C. | 露置于空气中,溶液浓度均降低 | |
| D. | 在空气中长期露置,溶液质量均减轻 |
分析 A.常温下,Al遇浓HNO3和浓H2SO4都可发生钝化;
B.浓硫酸与Cu反应需要加热;
C.浓硝酸易挥发,浓硫酸具有吸水性;
D.浓硫酸吸水性.
解答 解:A.常温下,Al遇浓HNO3和浓H2SO4都可发生钝化,则常温下都能用铝制容器贮存,故A错误;
B.浓硫酸与Cu反应需要加热,常温下浓硝酸能与铜较快,故B错误;
C.浓硝酸易挥发使溶质减少,浓硫酸具有吸水性使溶剂增多,则露置在空气中,容器内酸液的浓度都降低,故C正确;
D.浓硫酸吸水性,所以质量增加,故D错误;
故选C.
点评 本题考查浓硝酸和浓硫酸的性质,为高频考点,把握浓酸的强氧化性、浓硫酸的三大特性为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
4.用锌块与30mL3mol/L盐酸反应制取H2气体,若要增大反应速率,可采取的措施是( )
①再加入30mL3mol/L盐酸
②改用30mL6mol/L盐酸
③改用粉末状锌
④适当升高温度
⑤加入几滴CuSO4溶液.
①再加入30mL3mol/L盐酸
②改用30mL6mol/L盐酸
③改用粉末状锌
④适当升高温度
⑤加入几滴CuSO4溶液.
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ②③④⑤ |
8.X、Y、Z、W、R属于短周期主族元素,X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )
| A. | 离子半径的大小顺序为:r(R2-)>r(X+)>r(Y2-) | |
| B. | 最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| C. | Y与X形成的化合物和Y与W形成的化合物化学键类型完全相同 | |
| D. | 分别向BaCl2溶液中通入RY2、WY2,均有白色沉淀生成 |
5.几种短周期元素的原子半径和主要化合价见下表
(1)写出Y与Q形成的化合物与氢氧化钠溶液反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(2)Z的气态氢化物的稳定性与L的气态氢化物的稳定性比较:HCl>H2S(写化学式)
(3)X、Y两种元素相比较,金属性较强的是镁(填名称),可以验证该结论的实验是bc.(填编号)
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(4)上述六种元素中最高价氧化物对应的水化物酸性最强的是HClO4(填化学式)
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +2 | -2 |
(2)Z的气态氢化物的稳定性与L的气态氢化物的稳定性比较:HCl>H2S(写化学式)
(3)X、Y两种元素相比较,金属性较强的是镁(填名称),可以验证该结论的实验是bc.(填编号)
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(4)上述六种元素中最高价氧化物对应的水化物酸性最强的是HClO4(填化学式)
2.绿色电源“二甲醚【(CH3)2O】-氧气燃料电池”的工作原理如图所示,下列说法正确的是( )
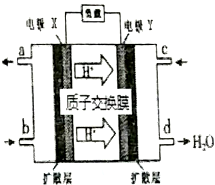

| A. | 氧气应从c处通入,电极Y上发生的反应为:O2+4e-+2H2O═4OH- | |
| B. | 电池在放电过程中,电极X周围溶液的pH增大 | |
| C. | 当该电池向外电路提供2 mol电子时消耗O2约为11.2L | |
| D. | 二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O-12e-+3H2O═2CO2+12H+ |
 的名称(系统命名)为3,4,4一三甲基一l一戊炔.
的名称(系统命名)为3,4,4一三甲基一l一戊炔.