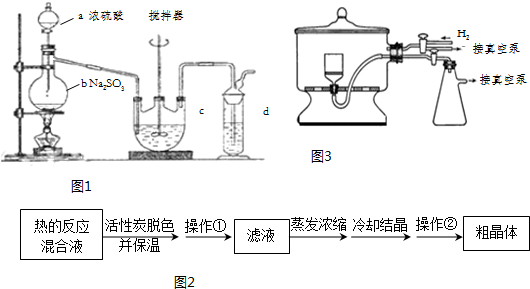
题目内容
10.下列过程不可逆的是( )| A. | 食盐的溶解 | B. | 硬脂酸钠的盐析 | C. | CuCl2的水解 | D. | 蛋白质的变性 |
分析 A.食盐加水溶解,蒸发可得固体食盐;
B.硬脂酸钠的盐析溶解度减小析出,加入水会继续溶解;
C.盐类的水解比较微弱,存在水解平衡,是可逆过程;
D.蛋白质变性是在某些物理因素和化学因素影响下,蛋白质失去原有的生理活性.
解答 解:A.食盐加水溶解,蒸发食盐析出,因此食盐的溶解是可逆的过程,故A错误;
B.硬脂酸钠的盐析溶解度减小析出,加入水会继续溶解,因此是一个可逆过程,故B错误;
C.CuCl2的水解比较微弱,存在水解平衡,是一个可逆过程,故C错误;
D.蛋白质变性是在某些物理因素和化学因素影响下,蛋白质的理化性质和生理功能发生改变的现象,是一个不可逆过程,故D正确;
故选D.
点评 本题考查了可逆反应的特征分析应用,主要是理解物质性质的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
1.下列方法可以加快锌和稀硫酸反应生成氢气的反应速率的是( )
| A. | 改用98%的浓硫酸 | B. | 降温 | C. | 加入CuSO4固体 | D. | 加水 |
18.下列性质中不属于烷烃具有性质的是( )
| A. | 燃烧产物只有CO2和H2O | B. | 与溴水发生取代反应 | ||
| C. | 都难溶于水 | D. | 通常不与强酸、强碱、强氧化剂反应 |
5.将0.96g铜投入到一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标况下672mL气体.将盛有此气体的容器倒扣在水中.通入标准状况下一定体积的O2恰好使气体完全溶于水中,则通入的O2的体积是( )
| A. | 540 mL | B. | 336 mL | C. | 224 mL | D. | 168 mL |
2.mg甲烷燃烧后得到CO、CO2和H2O(g)组成的混合气体,其质量为14.4克.将其通过足量碱石灰后,气体质量变为2.8克.则混合气体中H2O的质量是多少( )
| A. | 3.6g | B. | 1.8g | C. | 7.2g | D. | 4.8g |
14.从下列事实所得出的相应结论正确的是( )
| 实验事实 | 结论 | |
| A | A元素的原子半径比B元素的原子半径大 | 周期表中A位于B的下一周期 |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| C | 常温下,铜能与浓硝酸反应而铝被浓硝酸钝化 | 还原性:Cu>Al |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| A. | A | B. | B | C. | C | D. | D |
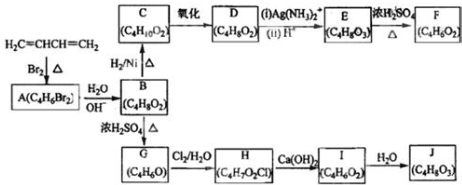
 ;
; +H2O,E中的官能团有羟基、羧基(填名称),与E具有相同官能团的E的同分异构体还有
+H2O,E中的官能团有羟基、羧基(填名称),与E具有相同官能团的E的同分异构体还有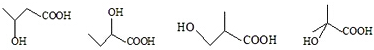 (写出结构简式,不考虑立体结构);
(写出结构简式,不考虑立体结构);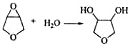 .
.