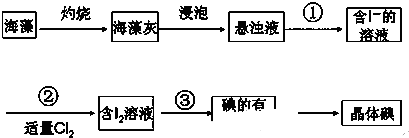
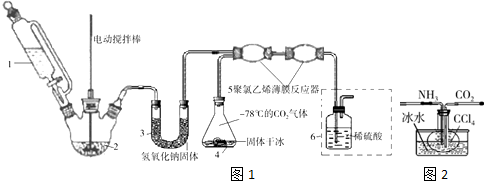
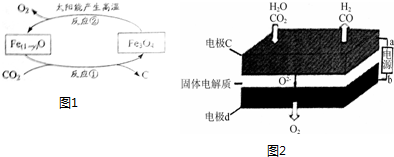
题目内容
2.mg甲烷燃烧后得到CO、CO2和H2O(g)组成的混合气体,其质量为14.4克.将其通过足量碱石灰后,气体质量变为2.8克.则混合气体中H2O的质量是多少( )| A. | 3.6g | B. | 1.8g | C. | 7.2g | D. | 4.8g |
分析 碱石灰吸收二氧化碳与水,剩余2.8g为CO的质量,可以计算二氧化碳与水的总质量,由甲烷分子式可知C、H原子数目之比为1:4,根据原子守恒可知2n(CO)+2n(CO2)=n(H2O),联立计算.
解答 解:碱石灰吸收二氧化碳与水,剩余2.8g为CO的质量,则二氧化碳与水的总质量=14.4g-2.8g=11.6g,
由甲烷分子式可知C、H原子数目之比为1:4,根据原子守恒可知2n(CO)+2n(CO2)=n(H2O),
CO的物质的量为$\frac{2.8g}{28g/mol}$=0.1mol,
设二氧化碳为xmol、水蒸气为ymol,则:
$\left\{\begin{array}{l}{44x+18y=11.6}\\{0.1×2+2x=y}\end{array}\right.$
解得x=0.1,y=0.4,
故水蒸气的质量为0.4mol×18g/mol=7.2g
故选:C.
点评 本题考查混合物有关计算,关键是根据甲烷分子式确定水蒸气物质的量与一氧化碳、二氧化碳总的物质的量关系.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
12.在恒容密闭容器中,可逆反应C(s)+CO2(g)?2CO,达到平衡状态的标志是( )
①单位时间内生成n molCO2的同时生成n molC
②单位时间内生成n molCO2 的同时生成2n mol CO
③CO2、CO的物质的量浓度之比为1:2的状态
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态 ⑥C的质量不再改变的状态.
①单位时间内生成n molCO2的同时生成n molC
②单位时间内生成n molCO2 的同时生成2n mol CO
③CO2、CO的物质的量浓度之比为1:2的状态
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态 ⑥C的质量不再改变的状态.
| A. | ①④⑤⑥ | B. | ②③⑤⑥ | C. | ②④⑤⑥ | D. | ①②③④ |
13.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,22.4 L NH3中含有共价键的数目为3NA | |
| B. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 标准状况下,11.2 L CCl4所含的分子数目为0.5NA | |
| D. | 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2 NA |
10.下列过程不可逆的是( )
| A. | 食盐的溶解 | B. | 硬脂酸钠的盐析 | C. | CuCl2的水解 | D. | 蛋白质的变性 |
17.已知氮原子的质量数为14,则在NH3D1中,电子数、质子数、中子数之比为( )
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
8. 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点当滴入最后一滴标准液,溶液由无色变为浅红色,且半分钟内不退色.
(2)盐酸的物质的量浓度为0.10mol/L
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是偏高(填“偏高”或“偏低”或“无影响”,下同).
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在甲中(填“甲”或“乙”),该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:| 实验序号 | 待测液体积(ML) | 所消耗NaOH标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.4 |
(2)盐酸的物质的量浓度为0.10mol/L
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是偏高(填“偏高”或“偏低”或“无影响”,下同).
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在甲中(填“甲”或“乙”),该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.