题目内容
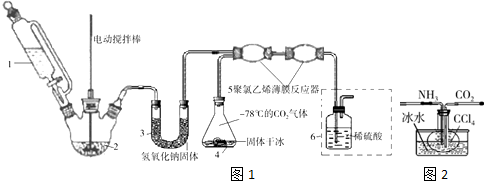
13.硫代硫酸钠晶体(Na2S2O3•5H2O)俗名“大苏打”,又称“海波”.已知Na2S2O3•5H2O是无色透明晶体,易溶于水,不溶于乙醇.它受热、遇酸易分解,在空气中易被氧化.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).反应原理为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2.Ⅰ.(图1)制备Na2S2O3
(1)①仪器b的名称蒸馏烧瓶,d中盛放的试剂是氢氧化钠溶液.
②b中制备SO2,反应的化学方程式Na2SO3+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Na2SO4+SO2↑+H2O.
③反应开始后,要控制SO2生成速率,可以采取的措施有控制反应温度或调节酸的滴加速度等(写出一条即可).
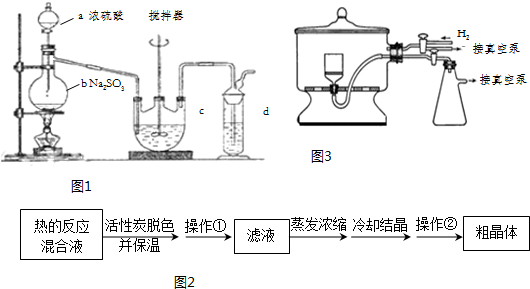
Ⅱ.分离Na2S2O3并测定含量(图2)
(2)为了减少产品损失,操作①时需趁热过滤.操作②是过滤、洗涤、干燥,其中洗涤操作时用
乙醇做洗涤剂.干燥操作时(装置如图3所示),通入H2的目的是排出空气,防止硫代硫酸钠被氧化.
(3)制得的粗晶体中往往含有少量杂质.为了测定粗产品中Na2S2O3•5H2O的含量,采用在酸性条件下用KMnO4标准液滴定的方法(假设粗产品中的杂质与酸性KMnO4溶液不反应).称取1.50g粗产品溶于水,用0.20mol•L-1KMnO4溶液(加适量稀硫酸酸化)滴定,当溶液中S2O32-全部被氧化时,消耗高锰酸钾溶液体积40.00mL.(5S2O32-+8MnO4-+14H+═8Mn2++10SO42-+7H2O)
①KMnO4溶液置于酸式(填“酸式”或“碱式”)滴定管中.
②若滴入最后一滴高锰酸钾标准液后,溶液恰好由无色变浅紫红色,且半分钟不褪色,则达到滴定终点.
③产品中Na2S2O3•5H2O的质量分数为82.7%(保留小数点后一位).
分析 (1)①由仪器结构可知,仪器b为蒸馏烧瓶;蒸馏烧瓶中浓硫酸与亚硫酸钠反应制备SO2,c装置中制备Na2S2O3,d装置吸收多余的二氧化硫,防止污染空气;
②b中制备SO2,浓硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫与水;
③控制反应温度或调节酸的滴加速度等控制SO2生成速率;
(2)需要趁热过滤,防止硫代硫酸钠晶体析出;
硫酸硫酸钠易溶于水,不溶于乙醇,为减少溶解单质的损失,应用乙醇洗涤;
硫代硫酸钠在空气中易被氧化;
(3)①KMnO4溶液具有强氧化性,可以腐蚀橡皮管;
②Na2S2O3反应完毕,再加入KMnO4标准溶液,颜色不褪去;
③由方程式可知n(Na2S2O3•5H2O)=n(S2O32-)=$\frac{5}{8}$n(KMnO4),进而计算Na2S2O3•5H2O在产品中的质量分数.
解答 解:(1)①由仪器结构可知,仪器b为蒸馏烧瓶;蒸馏烧瓶中浓硫酸与亚硫酸钠反应制备SO2,c装置中制备Na2S2O3,d装置吸收多余的二氧化硫,防止污染空气,应用氢氧化钠溶液吸收,
故答案为:蒸馏烧瓶;氢氧化钠溶液;
②b中制备SO2,浓硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Na2SO4+SO2↑+H2O;
③反应开始后,要控制SO2生成速率,可以采取的措施有:控制反应温度或调节酸的滴加速度等,
故答案为:控制反应温度或调节酸的滴加速度等;
控制SO2生成速率;
(2)需要趁热过滤,防止硫代硫酸钠晶体析出;
硫酸硫酸钠易溶于水,不溶于乙醇,为减少溶解单质的损失,应用乙醇洗涤;
用氢气排出空气,防止硫代硫酸钠被氧化,
故答案为:趁热过滤;乙醇;排出空气,防止硫代硫酸钠被氧化;
(3)①KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管中,
故答案为:酸式;
②Na2S2O3反应完毕,滴入最后一滴高锰酸钾标准液后,溶液恰好由无色变浅紫红色,且半分钟不褪色,说明反应到达终点,
故答案为:滴入最后一滴高锰酸钾标准液后,溶液恰好由无色变浅紫红色,且半分钟不褪色;
③由方程式可知n(Na2S2O3•5H2O)=n(S2O32-)=$\frac{5}{8}$n(KMnO4)=$\frac{5}{8}$×0.04L×0.2mol/L=0.005mol,则m(Na2S2O3•5H2O)=0.005mol×248g/mol=1.24g,则Na2S2O3•5H2O在产品中的质量分数为$\frac{1.24g}{1.5g}$×100%=82.7%,
故答案为:82.7%.
点评 本题考查物质制备实验、物质含量测定等,题目综合性较强,关键是对原理的理解,注意制备中渗入环保意识,熟练掌握元素化合物知识与实验制备基本原则,题目难度中等.

 名校课堂系列答案
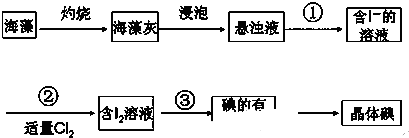
名校课堂系列答案| A. | 大量燃烧化石燃料是造成雾霾天气的原因之一 | |
| B. | 从海水中提取氯化钠、溴、碘不一定都要通过化学反应才能实现 | |
| C. | 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生 | |
| D. | 用高纯度的硅来制备光导纤维 |
| A. | 食盐的溶解 | B. | 硬脂酸钠的盐析 | C. | CuCl2的水解 | D. | 蛋白质的变性 |
 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:| 实验序号 | 待测液体积(ML) | 所消耗NaOH标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.4 |
(2)盐酸的物质的量浓度为0.10mol/L
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是偏高(填“偏高”或“偏低”或“无影响”,下同).
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在甲中(填“甲”或“乙”),该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
(1)如用图I装置制取氨气,可选择的试剂是氯化铵与氢氧化钙.
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中.当悬浮物较多时,停止制备.
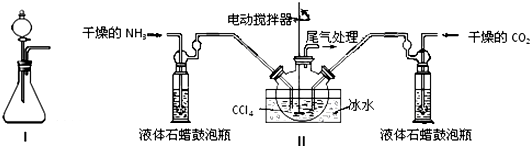
注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是防止反应放热使产物分解,提高反应物转化率,液体石蜡鼓泡瓶的作用是观察气泡调节NH3和CO2通入比例,控制反应速率.
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究,请填写表中空格.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入:_______. | _______,证明固体中含有碳酸氢铵. |