题目内容
13.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )| A. | 氢氧化铜与盐酸;氢氧化铜与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 | |
| C. | NaHCO3溶液与盐酸;Na2CO3与盐酸 | |
| D. | 石灰石与硝酸反应;石灰石与盐酸 |
分析 A.氯化氢为强电解质,而醋酸为弱电解质,离子方程式中需要保留分子式;
B.氢氧化钡与硫酸反应除了生成硫酸钡沉淀,还有水生成;
C.碳酸氢钠、碳酸钠在离子方程式中分别形成碳酸氢根离子、碳酸根离子形式;
D.二者反应实质都是碳酸钙与氢离子反应生成钙离子、二氧化碳和水.
解答 解:A.Cu(OH)2+HCl的离子方程式为:Cu(OH)2+2H+═Cu2++2H2O;醋酸为弱酸,离子方程式中需要保留分子式,醋酸与氢氧化铜反应的离子方程式为:Cu(OH)2+2CH3COOH═Cu2++2H2O+2CH3COO-,两个反应的离子方程式不同,故A错误;
B.BaCl2与H2SO4反应的离子方程式为:SO42-+Ba2+=BaSO4↓;Ba(OH)2与H2SO4反应生成硫酸钡和水,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,两个反应的离子方程式不同,故B错误;
C.NaHCO3与HCl的离子方程式为:HCO3-+H+═C02↑+H2O;Na2CO3+HCl的离子方程式为:CO32-+2H+═C02↑+H2O,两个反应的离子方程式不同,故C错误;
D.石灰石与硝酸反应、石灰石与盐酸的离子方程式都是:CaCO3+2H+=Ca2++H2O+CO2↑,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度不大,明确离子方程式表示的意义为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
3.下列事实一定能证明HNO2是弱电解质的是( )
①常温下NaNO2溶液的pH>7;
②用HNO2溶液做导电实验,灯泡很暗;
③HNO2和NaCl不能发生反应;
④0.1mol/L HNO2溶液的pH=2.1;
⑤NaNO2和H3PO4反应,生成HNO2;
⑥pH=1的 HNO2溶液稀释至100倍,pH约为2.3.
①常温下NaNO2溶液的pH>7;
②用HNO2溶液做导电实验,灯泡很暗;
③HNO2和NaCl不能发生反应;
④0.1mol/L HNO2溶液的pH=2.1;
⑤NaNO2和H3PO4反应,生成HNO2;
⑥pH=1的 HNO2溶液稀释至100倍,pH约为2.3.
| A. | ①④⑥ | B. | ②③④ | C. | 全部 | D. | ①④⑤⑥ |
8.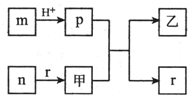 短周期主族元素W、X、Y、Z的原子半径依次增大,且X、Y原子序数之和是W、Z原子序数之和的2倍.m、n、p、r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙均是淡黄色固体.上述物质的转化关系如图所示(部分反应物或生成物省略).下列说法错误的是( )
短周期主族元素W、X、Y、Z的原子半径依次增大,且X、Y原子序数之和是W、Z原子序数之和的2倍.m、n、p、r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙均是淡黄色固体.上述物质的转化关系如图所示(部分反应物或生成物省略).下列说法错误的是( )
 短周期主族元素W、X、Y、Z的原子半径依次增大,且X、Y原子序数之和是W、Z原子序数之和的2倍.m、n、p、r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙均是淡黄色固体.上述物质的转化关系如图所示(部分反应物或生成物省略).下列说法错误的是( )
短周期主族元素W、X、Y、Z的原子半径依次增大,且X、Y原子序数之和是W、Z原子序数之和的2倍.m、n、p、r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙均是淡黄色固体.上述物质的转化关系如图所示(部分反应物或生成物省略).下列说法错误的是( )| A. | 热稳定性:p<r | |
| B. | X与Y组成的化合物一定有漂白性 | |
| C. | 含Y元素的盐溶液可能显酸性、中性或碱性 | |
| D. | Z与W、X、Y可形成离子化合物 |
18.下列陈述正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | 氢氧化铝可与盐酸反应 | 氢氧化铝可用于治疗胃酸过多 |
| D | 冷的浓硝酸与铁不发生反应 | 可以用铁槽车储运浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
5.在一定温度下,体积不变的密闭容器中,可逆反应X(g)+2Y(g)?2Z(g)达到平衡的标志是( )
| A. | 气体总质量保持不变 | B. | 消耗Z的速率与消耗X的速率相等 | ||
| C. | X、Y、Z的浓度不再发生变化 | D. | X、Y、Z的分子数之比为1:2:2 |
2.下列各组离子,能在溶液中大量共存的是( )
| A. | Na+、Mg2+、Cl-、SO42- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | K+、Al3+、SO42-、OH- |