题目内容
1.在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)?3C(g)+nD(g),开始时A为4mol,B为6mol;5min后达到化学平衡,此时C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L•min).(1)5min末B的物质的量浓度为2mol/L
(2)前5min内化学反应速率v(A)为0.1mol/(L•min)
(3)化学方程式中n值为2
(4)该反应在此温度下的平衡常数K=0.5625(填数值).
分析 5min后达到化学平衡,此时C的物质的量为3mol,v(C)=$\frac{\frac{3mol}{2L}}{5min}$=0.3mol/(L•min),用D表示的化学反应速率v(D)为0.2mol/(L•min),由速率之比等于化学计量数之比可知,$\frac{0.3}{0.2}=\frac{3}{n}$,解得n=2,则
A(g)+2B(g)?3C(g)+2D(g)
开始 4 6 0 0
转化 1 2 3 2
平衡 3 4 3 2
结合c=$\frac{n}{V}$、v=$\frac{△c}{△t}$及K为生成物浓度幂之积与反应物浓度幂之积的比来解答.
解答 解:5min后达到化学平衡,此时C的物质的量为3mol,v(C)=$\frac{\frac{3mol}{2L}}{5min}$=0.3mol/(L•min),用D表示的化学反应速率v(D)为0.2mol/(L•min),由速率之比等于化学计量数之比可知,$\frac{0.3}{0.2}=\frac{3}{n}$,解得n=2,则
A(g)+2B(g)?3C(g)+2D(g)
开始 4 6 0 0
转化 1 2 3 2
平衡 3 4 3 2
(1)5min末B的物质的量浓度为$\frac{4mol}{2L}$=2mol/L,故答案为:2mol/L;
(2)前5min内化学反应速率v(A)为$\frac{\frac{1mol}{2L}}{5min}$=0.1mol/(L•min),故答案为:0.1mol/(L•min);
(3)由上述分析可知化学方程式中n值为2,故答案为:2;
(4)A、B、C、D的平衡浓度分别为1.5mol/L、2mol/L、1.5mol/L、1mol/L,该反应在此温度下的平衡常数K=$\frac{1.{5}^{3}×{1}^{2}}{1.5×{2}^{2}}$=0.5625,故答案为:0.5625.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、K及速率的计算为解答的关键,侧重分析与计算能力的考查,注意n的确定方法及利用平衡浓度计算K,题目难度不大.

| A. | 用热碱液清除炊具上残留的油污 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 用含硅胶、铁粉的透气小袋和食品一起密封包装 | |
| D. | 用活性炭去除冰箱中的异味 |
| A. | 明矾净水的原理和家用消毒液消毒的原理相同,都能起到消毒杀菌作用 | |
| B. | 聚乙烯、聚氯乙烯都是高分子化合物,但聚氯乙烯薄膜不能用于包装食品 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 铝合金的大量使用,归功于人们能用焦炭等还原剂从氧化铝中获得铝 |
| 选项 | 现象或事实 | 解释 |
| A | 用热的烧碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反 应生成CaCO3 |
| C | 施肥时,草木灰(有效成分为K2CO3)不能 与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低 肥效 |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 常温常压下,30 g乙烷气体中所含有的共价键数目为6NA | |
| B. | 标准状况下,0.4 g D2中所含中子的数目为0.2NA | |
| C. | 常温下,1 L pH=12的氨水溶液中含有NH4+数目为0.01NA | |
| D. | 标准状况下,盛有11.2 L NO2的密闭容器中氮原子数为0.5NA |
| A. | 氢氧化铜与盐酸;氢氧化铜与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 | |
| C. | NaHCO3溶液与盐酸;Na2CO3与盐酸 | |
| D. | 石灰石与硝酸反应;石灰石与盐酸 |
(1)2A(g)?2B(g)+C(g);
(2)A(g)?C(g)+D(g).当达到平衡时,测得c(A)=2.5mol•L-1,c(C)=2.0mol•L-1.则下列说法中正确的是( )
| A. | 达到平衡时A的总转化率为40% | B. | 达到平衡时c(B)为1.0mol•L-1 | ||
| C. | 达到平衡时c(B)=2c(D) | D. | 达到平衡时c(D)为0.5mol•L-1 |
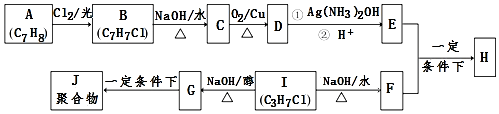
 .
. .
.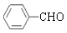 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.