题目内容
5.在一定温度下,体积不变的密闭容器中,可逆反应X(g)+2Y(g)?2Z(g)达到平衡的标志是( )| A. | 气体总质量保持不变 | B. | 消耗Z的速率与消耗X的速率相等 | ||
| C. | X、Y、Z的浓度不再发生变化 | D. | X、Y、Z的分子数之比为1:2:2 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、气体总质量一直保持不变,故A错误;
B、消耗Z的速率与消耗X的速率相等,速率之比不等于计量数之比,故B错误;
C、X、Y、Z的浓度不再发生变化,说明各物质的量不变,反应达平衡状态,故C正确;
D、当体系达平衡状态时,X、Y、Z的分子数之比可能为1:2:2,也可能不是1:2:2,与各物质的初始浓度及转化率有关,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是电子层数的三倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多2,W与X同主族,则( )
| A. | 原子半径:Y<Z<W | |
| B. | 单质的还原性:Y<Z | |
| C. | 简单气态氢化物的稳定性:X>W | |
| D. | Y和Z两者最高价氧化物对应的水化物不能相互反应 |
13.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | 氢氧化铜与盐酸;氢氧化铜与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 | |
| C. | NaHCO3溶液与盐酸;Na2CO3与盐酸 | |
| D. | 石灰石与硝酸反应;石灰石与盐酸 |
20.下列说法中,正确的是( )
| A. | SO2能使FeCl3、酸性KMnO4溶液迅速褪色 | |
| B. | 可以用澄清石灰水来鉴别SO2与CO2 | |
| C. | 氨气和酸相遇都能产生白色烟雾 | |
| D. | 在反应NH3++H+=NH4+中,氨失去电子被氧化 |
17.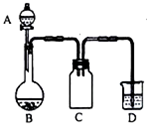 实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:
实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:
(1)写出Cu2O与混酸发生的反应的离子方程式:3Cu2O+2NO3-+14H+═6Cu2++2NO↑+7H2O.
(2)C装置的作用是防止D中溶液到吸入B中(或防倒吸).
(3)D装置中的NaClO-NaOH混合溶液用来吸收无色尾气,吸收液与尾气发生反应的化学方程式为3NaClO+2NaOH+2NO═3NaCl+2NaNO3+H2O.
(4)制得的CuSO4溶液可能会含有Cu(NO3)2,为避免Cu(NO3)2的生成,在制备时应采取的措施是加入的硝酸不过量(或定量加入硝酸).
(5)某同学设计下列实验证明氢硫酸为二元弱酸,填写表中空白:
 实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:
实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:(1)写出Cu2O与混酸发生的反应的离子方程式:3Cu2O+2NO3-+14H+═6Cu2++2NO↑+7H2O.
(2)C装置的作用是防止D中溶液到吸入B中(或防倒吸).
(3)D装置中的NaClO-NaOH混合溶液用来吸收无色尾气,吸收液与尾气发生反应的化学方程式为3NaClO+2NaOH+2NO═3NaCl+2NaNO3+H2O.
(4)制得的CuSO4溶液可能会含有Cu(NO3)2,为避免Cu(NO3)2的生成,在制备时应采取的措施是加入的硝酸不过量(或定量加入硝酸).
(5)某同学设计下列实验证明氢硫酸为二元弱酸,填写表中空白:
| 实验一 证明H2S是弱酸 | 实验操作 | 取VmL未知浓度的H2S溶液,测其pH值为a,再向溶液中加入适量的无水CuSO4粉末,充分反应后再测其pH值为b,用过滤器将溶液中的不容物滤出,并用蒸馏水洗涤不容物,洗净,晾干并称量质量为m克. |
| 分析及结论 | 由实验中的数据可求得H2S溶液的物质的量浓度为:$\frac{1000m}{96V}$mol•L-1; 通过比较a和b数值的大小(或a>b)说明氢硫酸是弱酸. | |
| 实验原理 | 写出上述实验的化学反应方程式:CuSO4+H2S═CuS↓+H2SO4 | |
| 实验二 证明H2S是二元酸 | 实验操作 | 用已知浓度的NaOH溶液去滴定上述H2S溶液 |
| 分析及结论 | 通过实验若得出2n(H2S)=n(NaOH)(或消耗n(NaOH)为n(H2S)的二倍)即可说明H2S是二元酸 |
8.常温下,已知Ksp(AgCl)>Ksp( AgBr),现将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,下列有关说法不正确的是( )
| A. | 根据Ksp(AgCl)>Ksp( AgBr),可知AgCl的溶解能力比AgBr强 | |
| B. | 加入足量浓AgNO3溶液后,AgCl和AgBr的溶度积Ksp均不变 | |
| C. | 加入足量浓AgNO3溶液后,溶液中只有AgBr沉淀 | |
| D. | 在含有AgBr、AgCl固体的悬浊液中,c (Cl-)>c (Br-) |
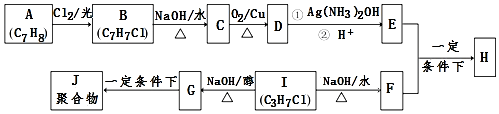
 .
. .
.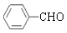 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.