题目内容
2.下列各组离子,能在溶液中大量共存的是( )| A. | Na+、Mg2+、Cl-、SO42- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | K+、Al3+、SO42-、OH- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.该组离子之间不反应,可大量共存,故A选;
B.Ca2+、CO32-结合生成沉淀,不能共存,故B不选;
C.H+、CO32-结合生成水和气体,不能共存,故C不选;
D.Al3+、OH-结合生成沉淀,不能共存,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | 明矾净水的原理和家用消毒液消毒的原理相同,都能起到消毒杀菌作用 | |
| B. | 聚乙烯、聚氯乙烯都是高分子化合物,但聚氯乙烯薄膜不能用于包装食品 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 铝合金的大量使用,归功于人们能用焦炭等还原剂从氧化铝中获得铝 |
13.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | 氢氧化铜与盐酸;氢氧化铜与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 | |
| C. | NaHCO3溶液与盐酸;Na2CO3与盐酸 | |
| D. | 石灰石与硝酸反应;石灰石与盐酸 |
17.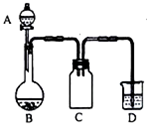 实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:
实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:
(1)写出Cu2O与混酸发生的反应的离子方程式:3Cu2O+2NO3-+14H+═6Cu2++2NO↑+7H2O.
(2)C装置的作用是防止D中溶液到吸入B中(或防倒吸).
(3)D装置中的NaClO-NaOH混合溶液用来吸收无色尾气,吸收液与尾气发生反应的化学方程式为3NaClO+2NaOH+2NO═3NaCl+2NaNO3+H2O.
(4)制得的CuSO4溶液可能会含有Cu(NO3)2,为避免Cu(NO3)2的生成,在制备时应采取的措施是加入的硝酸不过量(或定量加入硝酸).
(5)某同学设计下列实验证明氢硫酸为二元弱酸,填写表中空白:
 实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:
实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:(1)写出Cu2O与混酸发生的反应的离子方程式:3Cu2O+2NO3-+14H+═6Cu2++2NO↑+7H2O.
(2)C装置的作用是防止D中溶液到吸入B中(或防倒吸).
(3)D装置中的NaClO-NaOH混合溶液用来吸收无色尾气,吸收液与尾气发生反应的化学方程式为3NaClO+2NaOH+2NO═3NaCl+2NaNO3+H2O.
(4)制得的CuSO4溶液可能会含有Cu(NO3)2,为避免Cu(NO3)2的生成,在制备时应采取的措施是加入的硝酸不过量(或定量加入硝酸).
(5)某同学设计下列实验证明氢硫酸为二元弱酸,填写表中空白:
| 实验一 证明H2S是弱酸 | 实验操作 | 取VmL未知浓度的H2S溶液,测其pH值为a,再向溶液中加入适量的无水CuSO4粉末,充分反应后再测其pH值为b,用过滤器将溶液中的不容物滤出,并用蒸馏水洗涤不容物,洗净,晾干并称量质量为m克. |
| 分析及结论 | 由实验中的数据可求得H2S溶液的物质的量浓度为:$\frac{1000m}{96V}$mol•L-1; 通过比较a和b数值的大小(或a>b)说明氢硫酸是弱酸. | |
| 实验原理 | 写出上述实验的化学反应方程式:CuSO4+H2S═CuS↓+H2SO4 | |
| 实验二 证明H2S是二元酸 | 实验操作 | 用已知浓度的NaOH溶液去滴定上述H2S溶液 |
| 分析及结论 | 通过实验若得出2n(H2S)=n(NaOH)(或消耗n(NaOH)为n(H2S)的二倍)即可说明H2S是二元酸 |
7.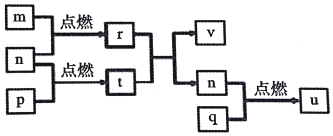 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:W>Z>Y>X | |
| B. | Z分别与Y、W组成的化合物中化学键类型可能相同 | |
| C. | v能抑制水的电离而u能促进水的电离 | |
| D. | 粘有q的试管可用酒精洗涤 |
4.在1升密闭容器中,加入5molA物质,在一定条件下同时发生下列两个反应:
(1)2A(g)?2B(g)+C(g);
(2)A(g)?C(g)+D(g).当达到平衡时,测得c(A)=2.5mol•L-1,c(C)=2.0mol•L-1.则下列说法中正确的是( )
(1)2A(g)?2B(g)+C(g);
(2)A(g)?C(g)+D(g).当达到平衡时,测得c(A)=2.5mol•L-1,c(C)=2.0mol•L-1.则下列说法中正确的是( )
| A. | 达到平衡时A的总转化率为40% | B. | 达到平衡时c(B)为1.0mol•L-1 | ||
| C. | 达到平衡时c(B)=2c(D) | D. | 达到平衡时c(D)为0.5mol•L-1 |
5.一定温度下,向2.0L恒容密闭容器中充入1.0mol A,经一段时间后反应A(g)?B(g)+C(g)达到平衡.反应过程中测定的部分数据见表:下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(B)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 前50s内B的平均反应速率v(B)=0.0032mol•L-1•s-1 | |
| B. | 相同温度下,若达平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大 | |
| C. | 相同温度下,若起始时向容器中充入1.0mol A、0.20mol B和0.20mol C,则达到平衡前 v(正)>V(逆) | |
| D. | 若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2mol.L-1,则反应的△H<0 |

 .
. .
. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.