题目内容
3.瓦斯中CH4与O2的质量比为1:4时极易爆炸,此时它们的体积比为( )| A. | 1:4 | B. | 1:3 | C. | 1:2 | D. | 1:1 |
分析 令甲烷与氧气的质量分别为1g、4g,根据n=$\frac{m}{M}$计算甲烷、氧气的物质的量,同温同压下,二者体积之比等于物质的量之比,据此计算判断.
解答 解:甲烷与氧气的质量比为1:4,令甲烷与氧气的质量分别为1g、4g,则:
lg甲烷的物质的量为$\frac{1g}{16g/mol}$=$\frac{1}{16}$mol,
4g氧气的物质的量为$\frac{4g}{32g/mol}$=$\frac{1}{8}$mol.
同温同压下,甲烷与氧气的体积之比等于物质的量之比为$\frac{1}{16}$mol:$\frac{1}{8}$mol=1:2.
故选:C.
点评 本题考查阿伏伽德罗定律及推论的计算,难度不大,根据同温同压下,体积之比等于物质的量之比,判断气体的物质的量是解题关键.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
1.常温下,将pH=2的盐酸与pH=2的醋酸溶液等体积混合后,溶液的pH( )
| A. | =2 | B. | >2 | C. | <2 | D. | 无法确定 |
14.根据下列有关图象,说法正确的是( )
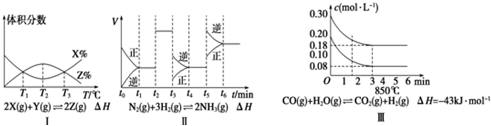

| A. | 由图I知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 由图II知,反应在t1时,NH3体积分数最大 | |
| C. | 由图II知,t3时采取的措施是降低反应体系温度 | |
| D. | III在10 L容器、850℃时反应,由图知,到4 min时,反应放出5.16 kJ的热量 |
11.下列有关说法正确的是( )
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类数相同 | |
| B. | 乙烷、苯、裂化汽油溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环已烷的密度都比水大 | |
| D. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 |
18.聚合氯化铝(PAC)是常用于水质净化的无机高分子混凝剂,其化学式可表示为[Al2(OH)nCl6-n]m(n<6,m为聚合度).PAC常用高温活化后的高岭土(主要化学组成为Al2O3、SiO2、Fe2O3)进行制备,工艺流程如图1所示:
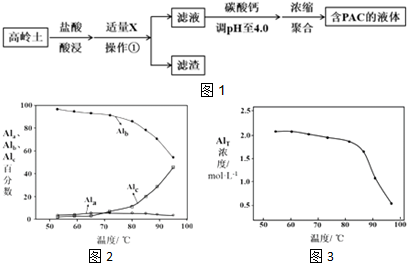
(1)盐酸酸浸所涉及反应的离子方程式是6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O.
(2)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释加入X的主要目的:调节溶液pH至Fe3+完全沉淀,滤渣中主要含有物质的化学式是Fe(OH)3、SiO2.
(3)已知:生成液体PAC的反应为2Al3++m(6-n) Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+.用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低.请解释pH偏小液体PAC产率降低的原因:pH偏小时,抑制平衡2Al3++m(6-n)Cl-+mnH2O?[Al2(OH)nCl6-n]m+mnH+正向移动生成PAC.
(4)浓缩聚合得到含PAC的液体中铝的各种形态主要包括:
Ala--Al3+单体形态铝
Alb--[Al2(OH)nCl6-n]m聚合形态铝
Alc--Al(OH)3胶体形态
图2为Al各形态百分数随温度变化的曲线;图3为含PAC的液体中铝的总浓度AlT随温度变化的曲线.
①50-90℃之间制备的液体PAC中,聚合形态铝含量最多.
②当T>80℃时,AlT明显降低的原因是温度升高,导致液体PAC向Al(OH)3沉淀转化.

(1)盐酸酸浸所涉及反应的离子方程式是6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O.
(2)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |
根据表中数据解释加入X的主要目的:调节溶液pH至Fe3+完全沉淀,滤渣中主要含有物质的化学式是Fe(OH)3、SiO2.
(3)已知:生成液体PAC的反应为2Al3++m(6-n) Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+.用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低.请解释pH偏小液体PAC产率降低的原因:pH偏小时,抑制平衡2Al3++m(6-n)Cl-+mnH2O?[Al2(OH)nCl6-n]m+mnH+正向移动生成PAC.
(4)浓缩聚合得到含PAC的液体中铝的各种形态主要包括:
Ala--Al3+单体形态铝
Alb--[Al2(OH)nCl6-n]m聚合形态铝
Alc--Al(OH)3胶体形态
图2为Al各形态百分数随温度变化的曲线;图3为含PAC的液体中铝的总浓度AlT随温度变化的曲线.
①50-90℃之间制备的液体PAC中,聚合形态铝含量最多.
②当T>80℃时,AlT明显降低的原因是温度升高,导致液体PAC向Al(OH)3沉淀转化.
8.下列物质中属于非电解质的是( )
| A. | CO2 | B. | KOH | C. | Cu | D. | NaCl溶液 |
12.取物质的量浓度相等的CuCl2、FeCl3的混合溶液40mL平分于两只试管,向其中一只试管加入足量AgNO3溶液生成14.35g 沉淀,向另一只试管加入1.12g 还原铁粉充分反应后该试管溶液中存在的金属阳离子及其物质的量浓度是( )
| A. | Fe2+ 2mol/L、Cu2+ 0.5mol/L | B. | Fe2+ 1mol/L、Fe3+ 1mol/L | ||
| C. | Fe2+ 0.5mol/L、Cu2+ 0.25mol/L | D. | Fe2+ 1.5mol/L、Cu2+ 0.5mol/L |
13. 已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.
已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式CO.
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是NH3分子间能形成氢键,而HCl分子间没有氢键.
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是N>C>Na.
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的外围电子排布式为3d84s2.
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是sp;sp3.
③在方框内画出[QZ4]2-的空间构型(用虚线表示空间构型的轮廓)并表示出中心离子与配原子之间的化学键.
 已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.
已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
(1)写出与Y2互为等电子体的分子式CO.
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是NH3分子间能形成氢键,而HCl分子间没有氢键.
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是N>C>Na.
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的外围电子排布式为3d84s2.
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是sp;sp3.
③在方框内画出[QZ4]2-的空间构型(用虚线表示空间构型的轮廓)并表示出中心离子与配原子之间的化学键.