题目内容
9.下列各组顺序的排列不正确的是( )| A. | 离子半径:F->Mg2+>Al3+ | B. | 热稳定性:HCl>H2S>AsH3 | ||
| C. | 酸性:H3AlO3<H2CO3<H3PO4 | D. | 水溶性:SO2<H2S<NH3 |
分析 A.具有相同电子排布的离子中,原子序数大的离子半径小;
B.非金属性越强,对应氢化物越稳定;
C.非金属性越强,最高价氧化物的水化物酸性越强;
D.氨气含氢键极易溶于水,SO2与水反应,硫化氢可溶于水.
解答 解:A.具有相同电子排布的离子中,原子序数大的离子半径小,则离子半径:F->Mg2+>Al3+,故A正确;
B.非金属性越强,对应氢化物越稳定,则热稳定性:HCl>H2S>AsH3,故B正确;
C.非金属性越强,最高价氧化物的水化物酸性越强,则酸性:H3AlO3<H2CO3<H3PO4,故C正确;
D.氨气含氢键极易溶于水,SO2与水反应,硫化氢可溶于水,则水溶性:H2S<SO2<NH3,故D错误;
故选D.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
| A. |  从KI和I2的固体混合物中回收I2 | |
| B. |  除去乙醇中的苯酚 | |
| C. |  实验用CCl4提取溴水中的Br2 | |
| D. |  配制100mL 0.1000mol•L-1 K2Cr2O7溶液 |
4.下列有关化学用语表示正确的是( )
| A. | NH4Cl的电子式: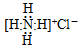 | |
| B. | 对硝基甲苯: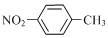 | |
| C. | 碳酸的电离方程式:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 硫离子的结构示意图: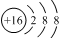 |
18.基于实验现象的推论,你认为合理的是( )
| 选项 | 实验现象 | 推论 |
| A | 乙烯气体可以使溴水褪色 | 乙烯发生取代反应 |
| B | 浓硫酸电导率比较低 | 硫酸浓度大时是弱电解质 |
| C | 氨气用于喷泉实验 | 氨气极易溶于水 |
| D | 硝酸溶液使pH试纸先变红后变白 | 硝酸酸性太强不能用pH试纸检测 |
| A. | A | B. | B | C. | C | D. | D |
8.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如表:
①此温度下该反应的平衡常数K=64.
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.

②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(3)Li2O、Na2O、MgO均能吸收CO2.①如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3.
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品.
反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2
高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.

②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(3)Li2O、Na2O、MgO均能吸收CO2.①如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3.
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品.
反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2
高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是CO2+2e-═CO+O2-.

 ,G的一种同分异构体的结构简式为
,G的一种同分异构体的结构简式为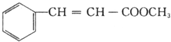 .
.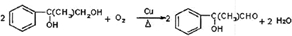
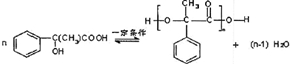 .
. 如图表示各物质间的转化关系.已知A、H为离子化合物,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,D、E为单质.
如图表示各物质间的转化关系.已知A、H为离子化合物,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,D、E为单质.