题目内容
 如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、4NH2(g)+5O2(g)?4NO(g)+6H2O(g)△H=-808.7Kj/mol |
| B、N2O3(g)?NO2(g)+NO(g)△H=+41.8Kj/mol |
| C、3NO2(g)+H2O(l)?2HNO2(l)+NO(g)△H=-261.3Kj/mol |
| D、CO2(g)+C(s)?2CO(g)△H=+171.4Kj/mol |
考点:体积百分含量随温度、压强变化曲线,化学反应速率的影响因素
专题:
分析:由图Ⅰ可知,到达平衡后,增大压强逆反应速率增大更大,平衡向逆反应移动,说明气体反应物的化学计量数之和小于气体生成物的化学计量数之和,由图Ⅱ可知,温度越高平衡时反应物的百分含量越高,说明升高温度,平衡向逆反应移动,故正反应为放热反应,据此结合选项解答.
解答:
解:由图Ⅰ可知,到达平衡后,增大压强逆反应速率增大更大,平衡向逆反应移动,说明气体反应物的化学计量数之和小于气体生成物的化学计量数之和,由图Ⅱ可知,温度越高平衡时反应物的百分含量越高,说明升高温度,平衡向逆反应移动,故正反应为放热反应,
A、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,正反应是气体物质的量增大的反应,且正反应是放热反应,符合反应特征,故A符合;
B、N2O3(g)?NO2(g)+NO(g)△H>0,正反应是气体物质的量增大的反应,但正反应是吸热反应,不符合反应特征,故B不符合;
C、3NO2(g)+H2O(l)?2HNO3(aq)+NO(g)△H<0,反应前后气体物质的量不变,正反应是放热反应,不符合反应特征,故C不符合;
D、CO2(g)+C(s)?2CO(g)△H=+171.4KJ/mol,正反应是吸热反应,不符合反应特征,故D不符合;
故选A.
A、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,正反应是气体物质的量增大的反应,且正反应是放热反应,符合反应特征,故A符合;
B、N2O3(g)?NO2(g)+NO(g)△H>0,正反应是气体物质的量增大的反应,但正反应是吸热反应,不符合反应特征,故B不符合;
C、3NO2(g)+H2O(l)?2HNO3(aq)+NO(g)△H<0,反应前后气体物质的量不变,正反应是放热反应,不符合反应特征,故C不符合;
D、CO2(g)+C(s)?2CO(g)△H=+171.4KJ/mol,正反应是吸热反应,不符合反应特征,故D不符合;
故选A.
点评:本题考查化学平衡移动图象,难度中等,把握图象中曲线的变化特点分析可逆反应的特征是解答该题的关键.

练习册系列答案
相关题目
下列关于氧化还原反应实质的说法中,比较确切的是( )
| A、有电子转移 |
| B、有电子得失 |
| C、得氧或失氧 |
| D、有元素化合价变化 |
根据下面的物质转换图,下列说法不正确的是( )
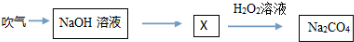

| A、Na2CO4是一种盐,其中碳为+6价 |
| B、X溶液中可能含两种盐 |
| C、该过程中没有发生氧化还原反应 |
| D、NaHCO3与盐酸和氢氧化钠均能反应 |
下列反应的离子方程式书写正确的是( )
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+═H2O+BaCO3↓ |
| C、NaHCO3溶液和过量Ba(OH)2溶液混合:2HCO3-+2OH-+Ba2+═BaCO3↓+2H2O+CO32- |
| D、NaAlO2溶液中通入少量CO2:2A1O2-+CO2+3H2O═2Al(OH)3↓+CO32- |

 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
 某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.
某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.