题目内容
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:(1)配制100mL 0.10mol/L NaOH标准溶液.
(2)滴定前的准备:①
①
(3)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 23.54 | 20.00 |
| 2 | 0.10 | 23.96 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
| 4 | 0.10 | 24.04 | 20.00 |
②盐酸的浓度为
③排除
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A、滴定终点读数时仰视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、滴定中振荡锥形瓶时,不小心有液体溅出
E、碱式滴定管尖嘴部分滴定前有气泡,滴定后消失.
考点:中和滴定
专题:实验题
分析:(2)滴定实验开始就检查滴定管是否漏液;待装液以后要排气泡;
(3)①酚酞在酸中为无色,在碱中为红色;
②先判断数据的合理性,求出标准NaOH溶液体积,然后求出标准NaOH溶液的平均体积,然后根据c(HCl)=
计算;
③碱式滴定管末端有橡胶管,酸式滴定管下端有活塞;碱式滴定管的气泡通常橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出;
④根据c(HCl)=
分析不当操作对V(NaOH)的影响,以此判断浓度的误差.
(3)①酚酞在酸中为无色,在碱中为红色;
②先判断数据的合理性,求出标准NaOH溶液体积,然后求出标准NaOH溶液的平均体积,然后根据c(HCl)=
| c(NaOH)×V(NaOH) |
| V(HCl) |
③碱式滴定管末端有橡胶管,酸式滴定管下端有活塞;碱式滴定管的气泡通常橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出;
④根据c(HCl)=
| c(NaOH)×V(NaOH) |
| V(HCl) |
解答:
解:(2)①滴定实验开始先检查滴定管是否漏液,
故答案为:查漏;
②在滴定管中装入溶液后,要把滴定管尖嘴部分的气泡排出去;
故答案为:排除滴定管尖嘴处的气泡;
(3)①酚酞在酸中为无色,在碱中为红色,达到滴定终点时盐酸被完全消耗,继续加一滴氢氧化钠溶液,溶液显弱碱性,酚酞变浅红色,则溶液由无色变为浅红色,且半分钟内不恢复原色说明已经达到滴定终点;
故答案为:溶液由无色变为浅红色,且半分钟内不恢复原色;
②第一次实验数据误差较大,舍去,其它三次消耗标准NaOH溶液体积分别为:23.86mL,23.90mL,23.040mL,所用标准液的平均体积为
=23.90mL,c(酸)=
=0.12mol/L;
故答案为:0.12mol/L;
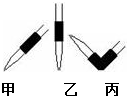
③碱式滴定管末端有橡胶管,酸式滴定管下端有活塞,图中为碱式滴定管,碱式滴定管的气泡通常橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出,
故答案为:碱;丙;
④A.滴定终点读数时仰视读数,造成V(NaOH)偏大,根据c(HCl)=
分析,待测液浓度偏高,故A正确;
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,待测液浓度偏小,待测液的物质的量偏小,造成V(NaOH)偏小,根据c(HCl)=
分析,待测液浓度偏低,故B错误;
C.锥形瓶水洗后未干燥,对V(NaOH)无影响,根据c(HCl)=
分析,待测液浓度无影响,故C错误;
D.滴定中振荡锥形瓶时,不小心有液体溅出,则盐酸的物质的量减小,则消耗的NaOH减少,根据c(HCl)=
分析,待测液浓度偏低,故D错误;
E.碱式滴定管尖嘴部分有气泡,滴定后消失,造成V(NaOH)偏大,根据c(HCl)=
分析,待测液浓度偏高,故E正确;
故答案为:AE.
故答案为:查漏;
②在滴定管中装入溶液后,要把滴定管尖嘴部分的气泡排出去;
故答案为:排除滴定管尖嘴处的气泡;
(3)①酚酞在酸中为无色,在碱中为红色,达到滴定终点时盐酸被完全消耗,继续加一滴氢氧化钠溶液,溶液显弱碱性,酚酞变浅红色,则溶液由无色变为浅红色,且半分钟内不恢复原色说明已经达到滴定终点;
故答案为:溶液由无色变为浅红色,且半分钟内不恢复原色;
②第一次实验数据误差较大,舍去,其它三次消耗标准NaOH溶液体积分别为:23.86mL,23.90mL,23.040mL,所用标准液的平均体积为
| 23.86mL+23.90mL+23.94mL |
| 3 |
| 0.10mol/L×0.0239L |
| 0.020L |
故答案为:0.12mol/L;
③碱式滴定管末端有橡胶管,酸式滴定管下端有活塞,图中为碱式滴定管,碱式滴定管的气泡通常橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出,
故答案为:碱;丙;
④A.滴定终点读数时仰视读数,造成V(NaOH)偏大,根据c(HCl)=
| c(NaOH)×V(NaOH) |
| V(HCl) |
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,待测液浓度偏小,待测液的物质的量偏小,造成V(NaOH)偏小,根据c(HCl)=
| c(NaOH)×V(NaOH) |
| V(HCl) |
C.锥形瓶水洗后未干燥,对V(NaOH)无影响,根据c(HCl)=
| c(NaOH)×V(NaOH) |
| V(HCl) |
D.滴定中振荡锥形瓶时,不小心有液体溅出,则盐酸的物质的量减小,则消耗的NaOH减少,根据c(HCl)=
| c(NaOH)×V(NaOH) |
| V(HCl) |
E.碱式滴定管尖嘴部分有气泡,滴定后消失,造成V(NaOH)偏大,根据c(HCl)=
| c(NaOH)×V(NaOH) |
| V(HCl) |
故答案为:AE.
点评:本题考查了滴定实验操作,题目难度中等,学生要注意滴定实验中操作的顺序以及规范操作,且能对有误差能进行分析判断,侧重于考查学生的实验能力和数据处理能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
A、已知
| ||||||||||
| B、能说明NH3结合H+能力比H2O强:NH3+H3O+=NH+4+H2O | ||||||||||
| C、已知下列热化学方程式:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,则氢气的燃烧热为-242kJ/mol | ||||||||||
| D、已知中和热为-57.4kJ/mol,则NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H=-57.4kJ/mol |
下列有关铵根离子(NH4+)或铵盐的性质的叙述中,不正确的是( )
| A、溶液中NH4+和OH-在加热时可生成NH3 |
| B、铵盐受热分解均有生成NH3放出 |
| C、铵盐均易溶于水 |
| D、铵盐属于离子化合物 |
下列实验操作中,不正确的是( )
| A、用分液漏斗分离乙醇和水 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用加热的方法分离氯化钠和硝酸钾固体 |
| D、用四氯化碳萃取碘的饱和水溶液中的碘 |
下列离子在溶液中能大量共存,通NO2后仍能大量共存的一组是 ( )
| A、Na+、Mg2+、NO3-、SO42- |
| B、Ba2+、K+、Cl-、SO42- |
| C、Fe2+、Na+、Cl-、NO3- |
| D、K+、Ca2+、CH3COO-、HCO3- |
 如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、4NH2(g)+5O2(g)?4NO(g)+6H2O(g)△H=-808.7Kj/mol |
| B、N2O3(g)?NO2(g)+NO(g)△H=+41.8Kj/mol |
| C、3NO2(g)+H2O(l)?2HNO2(l)+NO(g)△H=-261.3Kj/mol |
| D、CO2(g)+C(s)?2CO(g)△H=+171.4Kj/mol |
室温下,下列溶液的离子浓度关系错误的是( )
| A、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
| B、NaHSO4 溶液:c(H+)=c(SO42-)+c(OH-) |
| C、pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)>c(H+)>c(NH4+ )>c(OH-) |
| D、Na2S溶液:c(Na+ )=2c(HS-)+2c(S2-)>2c(H2S) |
下列对硫酸的叙述正确的是( )
| A、因浓硫酸具有强氧化性,故不可用它来干燥氢气 |
| B、浓硫酸与浓氨水靠近时产生大量白烟 |
| C、浓硫酸有强氧化性,稀硫酸不具有氧化性 |
| D、浓硫酸具有腐蚀性,取用时要小心 |