题目内容
14.下列变化,必须要加入氧化剂才能实现的是( )| A. | HCl→H2 | B. | H2O2→O2 | C. | H2SO4→SO2 | D. | Fe→Fe3O4 |
分析 必须加入氧化剂才能实现,说明给予物质作还原剂,在反应中失电子化合价升高,据此分析解答.
解答 解:A.该反应中H元素化合价由+1价变为0价,所以HCl是氧化剂,需要还原剂才能实现,如Fe等,故A错误;
B.该反应中O元素化合价由-1价变为0价,所以双氧水是还原剂,但不需要氧化剂也能实现,如在二氧化锰作催化剂条件下发生分解反应,故B错误;
C.该反应中S元素化合价由+6价变为+4价,所以硫酸是氧化剂,需要还原剂才能实现,如Cu等,故C错误;
D.该反应中Fe元素化合价由0价变为+2、+3价,所以Fe作还原剂,需要氧化剂氧气才能实现,故D正确;
故选D.
点评 本题考查氧化剂、还原剂判断,为高频考点,侧重考查学生对基本概念理解及掌握,明确元素化合价变化与氧化剂、还原剂关系即可解答,易错选项是B.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
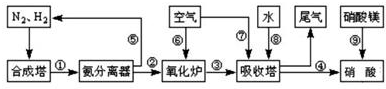
4. 工业合成氨与制备硝酸一般可连续生产,流程如图所示:
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1 (填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1< 573K(填“>”、“<”或“=”).
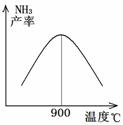
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示.温度高于900℃时,NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)═4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
(5)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
 工业合成氨与制备硝酸一般可连续生产,流程如图所示:
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1 (填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1< 573K(填“>”、“<”或“=”).
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)═4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
(5)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
5.下列叙述中不正确的是( )
| A. | 用SiO2制备硅酸不可能一步完成 | |
| B. | 使用澄清的石灰水可以鉴别Na2CO3和NaHCO3两种白色固体 | |
| C. | 把铁粉和铜粉放入FeCl3溶液充分反应后有固体剩余,固体中可能有铜无铁 | |
| D. | 烧碱溶液应保存在塞有橡胶塞的细口玻璃瓶中 |
2.下列说法中不正确的是( )
| A. | 人类历史上使用最早的合金是青铜 | |
| B. | 目前世界上用量最大的合金是钢 | |
| C. | 改变原料的配比、改变生成合金的条件,可以得到具有不同性质的合金 | |
| D. | 一般合金的熔点高于它的各成分金属 |
9.下列仪器对应的名称正确的是 ( )
| A. |  三脚架 | B. |  酸式滴定管 酸式滴定管 | C. |  长颈漏斗 | D. |  蒸发皿 |
3.下列各组选项按照电解质-→非电解质-→单质-→混合物顺序排列的一项是( )
| A. | HCl-→SO3-→石墨-→液氧 | B. | NaCl-→乙醇-→铁-→空气 | ||
| C. | 蔗糖-→CuSO4-→氮气-→波尔多液 | D. | KCl-→NaNO3-→氯气-→石灰水 |
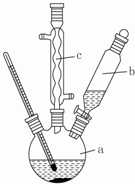 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: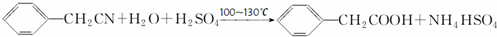 ;
;