题目内容
13.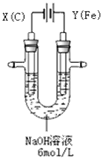 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示. 实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(1)电解过程中,X极是阴 极,电极反应是2H++2e-=H2↑;
(2)生成高铁酸根(FeO42-)的电极反应是Fe-6e-+8OH-=FeO4-+4H2O.
分析 根据电源的正负极判断电极名称,该电解池中,阳极材料是活泼金属,则电解池工作时,阳极上铁失电子发生氧化反应,同时氢氧根离子失电子生成氧气,阴极上氢离子得电子发生还原反应,据此回答.
解答 解:(1)X电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e-═H2↑,故答案为:阴;2H++2e-=H2↑;
(2)铁是活泼金属,电解池工作时,阳极上铁失电子发生氧化反应,氢氧根离子失电子发生氧化反应,所以发生的电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O和4OH--4e-═2H2O+O2↑,故答案为:Fe+8OH--6e-=FeO42-+4H2O.
点评 本题考查电解池工作原理,注意:电解池中如果活泼金属作阳极,则电解池工作时阳极材料失电子发生氧化反应,为易错点.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
3.下列各组选项按照电解质-→非电解质-→单质-→混合物顺序排列的一项是( )
| A. | HCl-→SO3-→石墨-→液氧 | B. | NaCl-→乙醇-→铁-→空气 | ||
| C. | 蔗糖-→CuSO4-→氮气-→波尔多液 | D. | KCl-→NaNO3-→氯气-→石灰水 |
1.(Ⅰ)在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)?2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol.回答下列问题:
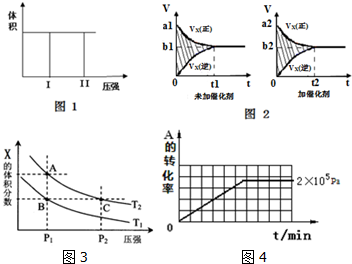
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C
B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法
(Ⅱ)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡不移动(填:向左,向右,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+bmol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式:K=$\frac{c(C){\;}^{p}}{c(A){\;}^{m}}$.
(4)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).

(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C
B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法
(Ⅱ)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+bmol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式:K=$\frac{c(C){\;}^{p}}{c(A){\;}^{m}}$.
(4)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).
8.关于硅的下列叙述中,正确的是?( )
| A. | 晶体硅与金刚石分子都是正四面体结构 | |
| B. | 硅酸盐都不溶于水? | |
| C. | 硅与酸、碱都不能发生反应 | |
| D. | 原硅酸和硅酸对应的酸酐都是二氧化硅 |
18.平衡常数的大小可以表示反应进行的程度,平衡常数越大,说明( )
| A. | 反应物平衡浓度较大 | B. | 反应越有利于往逆反应方向进行 | ||
| C. | 反应进行的越彻底 | D. | 生成物平衡浓度较小 |
3.如图为三种常见弱酸的电离平衡常数:则等物质的量浓度①CH3COONa溶液②Na2CO3溶液③NaHCO3溶液④NaClO溶液的pH由大到小的顺序正确的是( )
| 弱酸 | 电离常数 |
| CH3COOH | K=1.75×10-5 |
| H2CO3 | K1=4.4×10-7 k2=4.7×10-11 |
| HClO | K=3.2×10-8 |
| A. | ②>④>③>① | B. | ①>③>④>② | C. | ③>②>④>① | D. | ③>④>②>① |
 .
.