题目内容
1.除去溴乙烷中混有的Br2杂质,最佳的方法是( )| A. | 用四氯化碳萃取 | B. | 用氢氧化钠溶液洗涤 | ||
| C. | 用碘化钾溶液洗涤 | D. | 用亚硫酸氢钠溶液洗涤 |
分析 A.溴单质和溴乙烷都易溶于四氯化碳;
B.溴乙烷能够在氢氧化钠溶液中发生水解;
C.碘离子被氧化生成新的杂质;
D.亚硫酸氢钠能够被溴氧化,且溴乙烷不与亚硫酸氢钠溶液反应.
解答 解:A.溴和溴乙烷都易溶于四氯化碳,无法除去杂质,故A错误;
B.氢氧化钠溶液易使溴乙烷水解,故B错误;
C.碘离子被溴氧化成碘单质,碘单质易溶于溴乙烷,成了新的杂质,故C错误;
D.亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离,故D正确;
故选D.
点评 本题考查了物质的除杂与提纯,题目难度不大,根据杂质和被提纯物质的性质正确选用除杂试剂或方法为解答关键,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
9.下列离子方程式书写正确的是( )
| A. | 0.5mol•L-1的NaHSO3溶液与1.0mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ | |
| B. | 向Ca(HCO3)2溶液中加入足量的澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
6.实验室有下列试剂,其中必须用带橡胶塞的试剂瓶保存的是( )
①NaOH溶液 ②水玻璃 ③Na2S溶液 ④Na2CO3溶液 ⑤NH4Cl溶液 ⑥澄清石灰水 ⑦浓HNO3⑧浓H2SO4.
①NaOH溶液 ②水玻璃 ③Na2S溶液 ④Na2CO3溶液 ⑤NH4Cl溶液 ⑥澄清石灰水 ⑦浓HNO3⑧浓H2SO4.
| A. | ①⑥ | B. | ①②③④⑥ | C. | ①②③⑥⑦⑧ | D. | ⑤⑦⑧ |
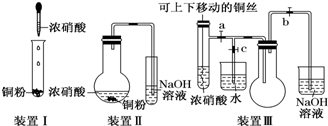
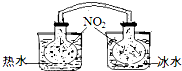 (1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深
(1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深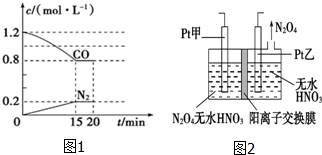 “霾”是当今世界环境热点话题.目前我国许多地方空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
“霾”是当今世界环境热点话题.目前我国许多地方空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: