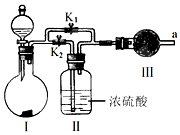
题目内容
6.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 在过氧化钠与水的反应中,固体每增重mg,转移电子的数目为mNA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2mol N2转移的电子数目为6NA | |
| D. | 标准状况下,1 mol CCl4的体积为22.4L |
分析 A.根据Na2O2与H2O的反应可知:每增重2g,转移1mol电子计算;
B.氯气与氢氧化钠反应为歧化反应;
C.依据方程式中氮元素化合价变化判断;
D.气体摩尔体积使用对象为气体.
解答 解:A.根据Na2O2与H2O的反应:2Na2O2+2H2O=4NaOH+O2↑可知:此反应增重4g,转移2mol电子,即增重2g时,转移NA个电子,故当每增重mg,转移电子的数目为$\frac{mN{\;}_{A}}{2}$,故A错误;
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应生成氯化钠和次氯酸钠,0.1mol氯气参加反应,转移的电子总数为0.1NA,故B错误;
C.2NH3+NO+NO2═2N2+3H2O,依据方程式可知升价的只有氨气中-3价氮,则2mol氨气参加反应,转移6mol电子,生成2mol氮气,故C正确;
D.标况下四氯化碳为液体,不能使用气体摩尔体积,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度中等.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
16.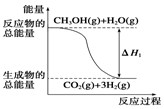 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | 1 mol CH3OH完全燃烧放出192.9 kJ热量 | |
| B. | 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程不一定要吸收能量 | |
| D. | 根据②推知:CH3OH(1)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H<-192.9 kJ•mol-1 |
17.进行化学实验必须注意安全,下列说法正确的是( )
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将酸溅到眼中,应立即用烧碱溶液冲洗,边洗边眨眼睛 | |
| C. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上稀硫酸 | |
| D. | 配制稀硫酸,可先在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸 |
14.某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量浓度之比为c(NO3-):c(SO42-):c(Fe3+):c(H+):c(M)=2:3:1:3:1,则M可能是( )
| A. | Al3+ | B. | Mg2+ | C. | Cl- | D. | Ba2+ |
1.下列各组中化合物的性质比较,正确的是( )
| A. | 稳定性:PH3>H2S>HCl | B. | 碱性:Al(OH)3>Mg(OH)2>NaOH | ||
| C. | 酸性:HIO4>HBrO4>HClO4 | D. | 非金属性:F>O>S |
18.下列说法正确的是( )
| A. | 影响气体体积大小的主要因素为微粒数目与微粒间的距离 | |
| B. | 可利用MnO2和浓盐酸常温下反应制取氯气 | |
| C. | 相同温度下,在水中Na2CO3的溶解度小于NaHCO3 | |
| D. | 氧化还原反应的本质是存在元素化合价的升降 |
16.锰及其化合物在生产、生活中有许多用途.
I.在实验室中模拟工业利用软锰矿(主要成分为MnO2,含少量SiO2、Fe2O3和A12O3等)制备金属锰等物质,设计流程如图1:

己知:碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如表.
(1)“酸浸”中MnO2反应的离子方程式为MnO2+2Fe2++4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Fe3++2H2O;滤渣I的成分是SiO2.
(2)向滤液I 中滴加双氧水的目的是将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去;测得滤液I 中c(Mn2+)=0.1mol•L-1,为保证滴加氨水不产生Mn(OH)2,应控制溶液pH最大为8.
(3)“沉锰”过程中的离子方程式为Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O或Mn2++HCO3-+NH3=MnCO3↓+NH4+.
(4)以Mn2O3和金属铝为原料可以制备粗锰,写出化学反应方程式Mn2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Mn.
II.科学家发明了NH3燃料电池,以KOH为电解质,原理如图2所示.
(5)该燃料电池的负极反应式为2NH3+6OH--6e-=N2+6H2O.
I.在实验室中模拟工业利用软锰矿(主要成分为MnO2,含少量SiO2、Fe2O3和A12O3等)制备金属锰等物质,设计流程如图1:

己知:碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如表.
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
(2)向滤液I 中滴加双氧水的目的是将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去;测得滤液I 中c(Mn2+)=0.1mol•L-1,为保证滴加氨水不产生Mn(OH)2,应控制溶液pH最大为8.
(3)“沉锰”过程中的离子方程式为Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O或Mn2++HCO3-+NH3=MnCO3↓+NH4+.
(4)以Mn2O3和金属铝为原料可以制备粗锰,写出化学反应方程式Mn2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Mn.
II.科学家发明了NH3燃料电池,以KOH为电解质,原理如图2所示.
(5)该燃料电池的负极反应式为2NH3+6OH--6e-=N2+6H2O.