题目内容
14.某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量浓度之比为c(NO3-):c(SO42-):c(Fe3+):c(H+):c(M)=2:3:1:3:1,则M可能是( )| A. | Al3+ | B. | Mg2+ | C. | Cl- | D. | Ba2+ |
分析 某溶液中含有NO3-、SO42-、Fe3+、H+、M,溶液不显电性,其物质的量浓度之比为c(NO3-):c(SO42-):c(Fe3+):c(H+):c(M)=2:3:1:3:1,利用电荷守恒及离子的共存来计算解答.
解答 解:已知物质的量之比为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,设各离子的物质的量分别为2mol、3mol、1mol、3mol、1mol,
则阴离子所带电荷n(NO3-)+2×n(SO42-)=2mol+2×3mol=8mol,
阳离子所带电荷3×n(Fe3+)+n(H+)=3×1mol+3mol=6mol,
阴离子所带电荷大于阳离子所带电荷,则M一定为阳离子,因M的物质的量为1mol,根据电荷守恒,则离子应带2个正电荷,
又因Ba2+与SO42-反应生成沉淀而不能大量共存,则B符合,
故选B.
点评 本题考查离子共存问题,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意根据电荷守恒判断M应为阳离子,结合离子反应问题判断.

练习册系列答案
相关题目
5.下列叙述中,正确的是( )
| A. | 无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分NaClO | |
| B. | 钢铁腐蚀的负极反应为:Fe-3e-=Fe3+ | |
| C. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| D. | H2-O2燃料电池中电解液为H2SO4,则正极反应式为:O2+4e-=2O2- |
9.在100mL 0.1mol/L NaOH的溶液中,所含NaOH的质量是( )
| A. | 40 g | B. | 4 g | C. | 0.4 g | D. | 0.04 g |
6.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 在过氧化钠与水的反应中,固体每增重mg,转移电子的数目为mNA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2mol N2转移的电子数目为6NA | |
| D. | 标准状况下,1 mol CCl4的体积为22.4L |
3.化学与社会生活密切相关.对下列现象或事实的解释错误的是( )
| 选项 | 现象或事实 | 解释 |
| A | 明矾可用作净水剂 | 明矾能水解生成Al(OH)3 胶体 |
| B | FeCl3溶液可用于腐蚀铜制印刷电路 | FeCl3 溶液能与Cu反应 |
| C | SO2可用于漂白纸浆 | SO2 具有氧化性 |
| D | 酸性或碱性表示食物不宜放在铝锅中久置 | 铝能与酸或碱反应 |
| A. | A | B. | B | C. | C | D. | D |
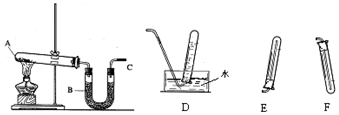
4.氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体.实验室中制备氯苯的装置如图所示(其中夹持仪器及加热装置略去)

请回答下列问题:
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸.打开仪器b中的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是有黄绿色气体生成,用离子方程式表示产生该现象的原因:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
(2)仪器b外侧玻璃导管的作用是使浓盐酸能顺利滴下(或答“平衡仪器a、b内的气压”).
(3)仪器d内盛有苯,FeCl3粉末固体,仪器a中生成的气体经过仪器e进入到仪器d中.
①仪器e的名称是洗气瓶,其盛装的试剂名称是浓硫酸.
②仪器d中的反应进行过程中,保持温度在40~60℃,以减少副反应发生.仪器d的加热方式最好是水浴加热,其优点是受热均匀,易于控制温度.
(4)仪器c的作用是冷凝、回流.
(5)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3,HCl及部分Cl2,然后通过碱洗除去Cl2;碱洗后通过分液得到含氯苯的有机物混合物,混合物成分及沸点如表一:
表一
从该有机物混合物中提取氯苯时,采用蒸馏的方法,收集132.2℃作用的馏分.
(6)实际工业生产中,苯的流失如表二:
表二:
某一次投产加入13t苯,则制得氯苯16.9t(保留一位小数).

请回答下列问题:
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸.打开仪器b中的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是有黄绿色气体生成,用离子方程式表示产生该现象的原因:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
(2)仪器b外侧玻璃导管的作用是使浓盐酸能顺利滴下(或答“平衡仪器a、b内的气压”).
(3)仪器d内盛有苯,FeCl3粉末固体,仪器a中生成的气体经过仪器e进入到仪器d中.
①仪器e的名称是洗气瓶,其盛装的试剂名称是浓硫酸.
②仪器d中的反应进行过程中,保持温度在40~60℃,以减少副反应发生.仪器d的加热方式最好是水浴加热,其优点是受热均匀,易于控制温度.
(4)仪器c的作用是冷凝、回流.
(5)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3,HCl及部分Cl2,然后通过碱洗除去Cl2;碱洗后通过分液得到含氯苯的有机物混合物,混合物成分及沸点如表一:
表一
| 有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
| 沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
(6)实际工业生产中,苯的流失如表二:
表二:
| 流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
| 苯流失量(kg/I) | 28.8 | 14.5 | 56.7 | 100 |