题目内容
9. 已知:
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
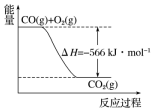
根据以上热化学方程式和图象判断,下列说法正确的是( )
| A. | CO的燃烧热为283kJ | |
| B. | 图可表示由1molCO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ•mol-1 | |
| D. | 根据以上热化学方程式无法求算Na2O2(s)+CO(g)═Na2CO3 (s) 的反应热 |
分析 A.依据燃烧热的概念分析计算判断;
B.图象中的焓变是2molCO完全燃烧反应的焓变;
C.根据热化学方程式中热量与物质的量之间的关系、物质由固态变气态吸收热量以及盖斯定律来解答;
D.根据题给热化学方程式结合盖斯定律可求算Na2O2(s)+CO(g)═Na2CO3 (s) 的反应热.
解答 解:A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为KJ/mol,CO的燃烧热为283kJ/mol,故A错误;
B.图象没有标明物质的状态,故B错误;
C.热化学方程式为2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ/mol,CO2(s)多一步变气体吸热的过程,所以本题放出的热量就少于452kJ,即△H>-452 kJ/mol,故C正确;
D.已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol ②Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1,根据盖斯定律合并热化学方程式$\frac{②×2+①}{2}$得到的热化学方程式为 CO(g)+Na2O2(s)=2Na2CO3(s),△H=-509kJ/mol,故D错误;
故选C.
点评 本题主要考查了燃烧热的概念、盖斯定律等知识,掌握燃烧热的概念应用,反应焓变的意义,盖斯定律的应用是解答关键,题目难度中等.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
20.下列有机物一氯代物的同分异构体数目与其他三种不同的是( )
| A. |  | B. |  | C. |  | D. |  |
17.短周期元素X、Y、Z、W在周期表中的相对位置如图所示,其中W元素的原子结构示意图为 .请回答下列问题:
.请回答下列问题:
(1)Z元素位于元素周期表中第三周期VA族.
(2)X元素的最简单气态氢化物能与其最高价氧化物对应的水化物反应,得到的化合物属于离子化合物 (填“离子化合物”或“共价化合物”).
(3)X、Y、Z三种元素的原子半径由大到小的顺序为P>N>O(用元素符号表示).
(4)写出W单质与X的最高价氧化物对应水化物的浓溶液反应的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
 .请回答下列问题:
.请回答下列问题:| W | X | Y |
| Z |
(2)X元素的最简单气态氢化物能与其最高价氧化物对应的水化物反应,得到的化合物属于离子化合物 (填“离子化合物”或“共价化合物”).
(3)X、Y、Z三种元素的原子半径由大到小的顺序为P>N>O(用元素符号表示).
(4)写出W单质与X的最高价氧化物对应水化物的浓溶液反应的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
14.下列变化需克服共价键的是( )
| A. | 干冰受热变成二氧化碳气体 | B. | 金刚石熔化 | ||
| C. | 蔗糖溶于水 | D. | 食盐溶于水 |
1.下列操作能达到目的是( )
| A. | 将一块带有氧化膜的铝片与过量的浓NaOH溶液完全反应后,取澄清溶液将其蒸干,得纯净的NaAlO2固体 | |
| B. | 向NaAlO2溶液中加入过量的A1C13溶液,将所得沉淀过滤洗涤,加热灼烧去掉水分,可得纯净的A1(OH)3固体 | |
| C. | 把铝块与适量的稀盐酸完全反应,将所得溶液蒸干,可得AlCl3固体 | |
| D. | AlC3溶液与足量氨水反应,将沉淀过滤、洗涤、灼烧去掉水分可得Al2O3固体 |
18.下列实验能达到预期目的是( )
| A. | 用溴水检验汽油中是否含有不饱和脂肪烃 | |
| B. | 除去苯中混有的苯酚,加入浓溴水,过滤 | |
| C. | 除去乙醇中混有的水,加入金属钠,蒸馏 | |
| D. | 乙烷气体中混有乙烯,通入酸性高锰酸钾溶液,洗气 |
19.下列实验中,实验现象及结论都正确且两者具有因果关系的是( )
| 实验 | 现象 | 结论 | |
| A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
| B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
| C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |