题目内容
14.下列变化需克服共价键的是( )| A. | 干冰受热变成二氧化碳气体 | B. | 金刚石熔化 | ||
| C. | 蔗糖溶于水 | D. | 食盐溶于水 |
分析 原子晶体熔化克服共价键,离子晶体熔化或电离均克服离子键,分子晶体发生三态变化只破坏分子间作用力,非电解质溶于水不发生电离,则不破坏化学键,以此来解答.
解答 解:A.干冰属于分子晶体,干冰受热变成二氧化碳气体,不破坏化学键,克服分子间作用力,故A不选;
B.金刚石为原子晶体,只存在共价键,熔化时克服共价键,故B选;
C.蔗糖为非电解质,溶于水不发生电离,则不破坏化学键,克服分子间作用力,故C不选;
D.食盐为离子晶体,溶于水发生电离,克服离子键,故D不选;
故选B.
点评 本题考查化学键及分子间作用力,把握物质的晶体类型、存在的化学键及电解质、非电解质为解答的关键,注意三态变化只克服分子间作用力,题目难度不大.

练习册系列答案
相关题目
5. 某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
 某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )| A. | 1:2:1 | B. | 1:3:1 | C. | 2:2:1 | D. | 1:3:3 |
2.下列说法中不正确的是( )
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 物质燃烧和酸碱中和均放出热量 | |
| C. | 需要加热的反应肯定是吸热反应 | |
| D. | 化学反应是吸热的还是放热的取决于生成物具有的总能量和反应物具有的总能量的相对大小 |
9.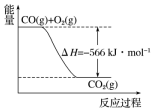 已知:
已知:
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式和图象判断,下列说法正确的是( )
 已知:
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式和图象判断,下列说法正确的是( )
| A. | CO的燃烧热为283kJ | |
| B. | 图可表示由1molCO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ•mol-1 | |
| D. | 根据以上热化学方程式无法求算Na2O2(s)+CO(g)═Na2CO3 (s) 的反应热 |
19.改变了“有机物就是有生命力的物质”观点的科学家是( )
| A. | 李比希 | B. | 维勒 | C. | 凯库勒 | D. | 诺贝尔 |
6.下列物质放入水中,会显著放热的是( )
| A. | 生石灰 | B. | 硝酸铵 | C. | 氯化钠 | D. | 蔗糖 |
3.下列反应过程中的能量变化情况符合如图的是( )


| A. | 石灰石高温分解反应 | B. | 镁和盐酸的反应 | ||
| C. | 酸与碱的中和反应 | D. | 氧化钙和水的反应 |

 $→_{②H+/H_{2}O}^{①HCN}$
$→_{②H+/H_{2}O}^{①HCN}$ (R'可以是烃基,也可以是H原子)
(R'可以是烃基,也可以是H原子) ,2分子E在浓硫酸、加热的条件下可以生成一种含六元环的化合物,该化合物的结构简式为
,2分子E在浓硫酸、加热的条件下可以生成一种含六元环的化合物,该化合物的结构简式为 .
. )的合成路线(无机试剂可以任选)
)的合成路线(无机试剂可以任选)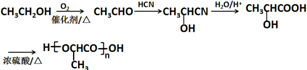 .
.