题目内容
1.下列操作能达到目的是( )| A. | 将一块带有氧化膜的铝片与过量的浓NaOH溶液完全反应后,取澄清溶液将其蒸干,得纯净的NaAlO2固体 | |
| B. | 向NaAlO2溶液中加入过量的A1C13溶液,将所得沉淀过滤洗涤,加热灼烧去掉水分,可得纯净的A1(OH)3固体 | |
| C. | 把铝块与适量的稀盐酸完全反应,将所得溶液蒸干,可得AlCl3固体 | |
| D. | AlC3溶液与足量氨水反应,将沉淀过滤、洗涤、灼烧去掉水分可得Al2O3固体 |
分析 A.完全反应后溶液中的溶质是偏铝酸钠和氢氧化钠;
B.完全反应后溶液中的溶质是氯化钠、氢氧化铝和氯化铝;
C.氯化铝是强酸弱碱盐易水解生成氢氧化铝和氯化氢,盐酸具有挥发性;
D.氯化铝和氨水反应生成氢氧化铝沉淀,灼烧氢氧化铝分解生成氧化铝.
解答 解:A.完全反应后溶液中的溶质是偏铝酸钠和氢氧化钠,且蒸干过程中,氢氧化钠和二氧化碳反应生成碳酸钠,所以得到的固体中还含有碳酸钠,所以得到的物质是混合物,故A错误;
B.完全反应后溶液中的溶质是氯化钠、氢氧化铝和氯化铝,加热蒸干溶液后再灼烧,得到的固体中含有氧化铝和氯化钠,所以得不到纯净物,故B错误;
C.氯化铝是强酸弱碱盐易水解生成氢氧化铝和氯化氢,盐酸具有挥发性促进氯化铝水解,最后得到的固体不是AlCl3而是A1(OH)3,故C错误;
D.氯化铝和氨水反应生成氢氧化铝沉淀,A1(OH)3在灼烧时生成Al2O3,故D正确;
故选D.
点评 本题考查化学实验方案的评价,题目难度不大,明确物质的性质是解本题关键,注意氢氧化铝能溶于强碱但不能溶于弱碱,将氯化铝溶液蒸干时得到的是氢氧化铝,如果将氯化铝溶液蒸干并灼烧得到的是氧化铝,二者不同,为易错点.

练习册系列答案
相关题目
11.二氧化氯被国际上公认为安全、无毒的绿色消毒剂,以KClO3溶液为原料,采用电解法生产二氧化氯反应原理如下:4ClO3-+2H2O$\frac{\underline{\;通电\;}}{\;}$4ClO2↑+O2↑+4OH-.下列说法正确的是( )
| A. | 电解过程中OH-向阴极迁移 | |
| B. | 阳极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 毎有l mol电子转移,生成标准状况下5.6L气体 | |
| D. | 电解过程中阴极区溶液的pH降低 |
12.X、Y、Z、W、R属于短周期主族元素.X的原子半径在短周期主族元素中最大,Y核素的最外层电子数为m,次外层电子数为n,Z原子的L层电子数为m+n,M层电子数为m-n≠0,W与Z同主族,R与Y的核外电子数之比为2:1,下列叙述错误的是( )
| A. | Y的氢化物比R的氢化物稳定,沸点高 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有6种 | |
| C. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
9.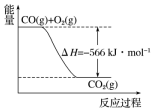 已知:
已知:
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式和图象判断,下列说法正确的是( )
 已知:
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式和图象判断,下列说法正确的是( )
| A. | CO的燃烧热为283kJ | |
| B. | 图可表示由1molCO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ•mol-1 | |
| D. | 根据以上热化学方程式无法求算Na2O2(s)+CO(g)═Na2CO3 (s) 的反应热 |
16.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 同主族元素性质的相似性 | 钠和氧反应可以形成Na2O2,也可以和硫形成Na2S2 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片分别加入足量的稀硫酸和浓硫酸中,浓硫酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | H2O沸点低于H2S |
| D | 较强酸可以制取较弱酸 | 亚硫酸和次氯酸钙反应可以制取次氯酸 |
| A. | A | B. | B | C. | C | D. | D |
6.下列物质放入水中,会显著放热的是( )
| A. | 生石灰 | B. | 硝酸铵 | C. | 氯化钠 | D. | 蔗糖 |
13.如图是某同学学习原电池后整理的学习笔记,错误的是( )

| A. | ①电子流动方向 | B. | ②电流方向 | ||
| C. | ③电极反应 | D. | ④溶液中离子移动方向 |
10. 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )
 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )| A. | 合金的熔点通常比组分金属高,硬度比组分金属小 | |
| B. | 已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2 | |
| C. | 用金属铝与V2O5反应冶炼钒,铝作还原剂 | |
| D. | V原子序数为23,该原子的价电子构型为4S24P1 |
11.关于${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、H+、${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2的说法,正确的是( )
| A. | 是氢元素的五种核素 | |
| B. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2互称为同素异形体 | |
| C. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H互称为同位素 | |
| D. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H的化学性质不同 |