题目内容
17.短周期元素X、Y、Z、W在周期表中的相对位置如图所示,其中W元素的原子结构示意图为 .请回答下列问题:
.请回答下列问题:| W | X | Y |
| Z |
(2)X元素的最简单气态氢化物能与其最高价氧化物对应的水化物反应,得到的化合物属于离子化合物 (填“离子化合物”或“共价化合物”).
(3)X、Y、Z三种元素的原子半径由大到小的顺序为P>N>O(用元素符号表示).
(4)写出W单质与X的最高价氧化物对应水化物的浓溶液反应的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
分析 由短周期元素W元素的原子结构示意图可知b=2,第二层电子数为4,则W是6号元素C,X是N元素,Y是O元素,Z是P元素.
(1)P元素有三个电子层,最外层电子数为5;
(2)X元素最简单气态氢化物是NH3,最高价氧化物对应的水化物是HNO3,二者反应得到硝酸铵;
(3)同周期从左向右原子半径减小,同主族从上到下原子半径增大;
(4)碳与浓硝酸在加热的条件下生成二氧化碳、二氧化氮、水.
解答 解:由短周期元素W元素的原子结构示意图可知b=2,第二层电子数为4,则W是6号元素C,X是N元素,Y是O元素,Z是P元素.
(1)P元素有三个电子层,最外层电子数为5,则P元素在第三周期第VA族,
故答案为:三;VA;
(2)X元素最简单气态氢化物是NH3,最高价氧化物对应的水化物是HNO3,二者反应得到硝酸铵,铵根与硝酸根间形成离子键,硝酸铵是离子化合物,
故答案为:离子化合物;
(3)同周期从左向右原子半径减小,同主族从上到下原子半径增大,则原子半径由大到小的顺序为:P>N>O,
故答案为:P>N>O;
(4)碳与浓硝酸在加热的条件下生成二氧化碳、二氧化氮、水,化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
点评 本题考查位置、结构、性质的关系,为高频考点,把握元素的位置推断元素及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
17.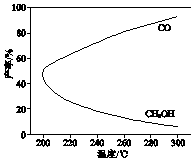 在一定条件下,利用CO2合成CH3OH的反应如下:
在一定条件下,利用CO2合成CH3OH的反应如下:
CO2(g)+3H2(g)?H3OH(g)+H2O(g)△H1,
研究发现,反应过程中会有副反应:
CO2(g)+H2(g)?CO(g)+H2O(g)△H2.
温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )
 在一定条件下,利用CO2合成CH3OH的反应如下:
在一定条件下,利用CO2合成CH3OH的反应如下:CO2(g)+3H2(g)?H3OH(g)+H2O(g)△H1,
研究发现,反应过程中会有副反应:
CO2(g)+H2(g)?CO(g)+H2O(g)△H2.
温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )
| A. | △H1<0,△H2>0 | |
| B. | 增大压强有利于加快合成反应的速率 | |
| C. | 生产过程中,温度越高越有利于提高CH3OH的产率 | |
| D. | 合成CH3OH反应的平衡常数表达式是K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$ |
8.某溶液中可能含有下列5种离子中的某几种:Cl-、SO42-、SO32-、NH4+、Na+.为确认溶液组成进行如下实验:①向100mL上述溶液中加入足量BaCl2溶液,反应后将浊液过滤、洗涤、干燥,得沉淀4.50g,若向沉淀中加入过量的盐酸,仍有2.33g沉淀不溶.同时产生能使湿润红色石蕊试纸褪色的气体.②向①的滤液中加入足量的NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体0.56L(已换算成标准状况,假定产生的气体全部逸出).下列说法正确的是( )
| A. | 一定存在SO42-、SO32-、NH4+,可能存在Na+ | |
| B. | 一定存在SO42-、SO32-、NH4+,一定不存在Cl-、Na+ | |
| C. | 溶液中可能含有Cl-,且Na+浓度至少为0.15mol•L-1 | |
| D. | c(SO42-)=0.1mol•L-1,c(NH4+)<c(SO42-) |
5.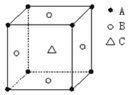 某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
 某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )| A. | 1:2:1 | B. | 1:3:1 | C. | 2:2:1 | D. | 1:3:3 |
12.X、Y、Z、W、R属于短周期主族元素.X的原子半径在短周期主族元素中最大,Y核素的最外层电子数为m,次外层电子数为n,Z原子的L层电子数为m+n,M层电子数为m-n≠0,W与Z同主族,R与Y的核外电子数之比为2:1,下列叙述错误的是( )
| A. | Y的氢化物比R的氢化物稳定,沸点高 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有6种 | |
| C. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
2.下列说法中不正确的是( )
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 物质燃烧和酸碱中和均放出热量 | |
| C. | 需要加热的反应肯定是吸热反应 | |
| D. | 化学反应是吸热的还是放热的取决于生成物具有的总能量和反应物具有的总能量的相对大小 |
9.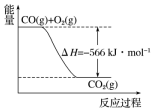 已知:
已知:
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式和图象判断,下列说法正确的是( )
 已知:
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式和图象判断,下列说法正确的是( )
| A. | CO的燃烧热为283kJ | |
| B. | 图可表示由1molCO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ•mol-1 | |
| D. | 根据以上热化学方程式无法求算Na2O2(s)+CO(g)═Na2CO3 (s) 的反应热 |
6.下列物质放入水中,会显著放热的是( )
| A. | 生石灰 | B. | 硝酸铵 | C. | 氯化钠 | D. | 蔗糖 |