题目内容
4.传统的制备合成氨原料气H2的方法是水煤气法.已知:①C(s)+H2O(g)═CO(g)+H2(g)△H1=﹢131.3KJ•mol-1
②C(s)+2H2O(g)═CO2(g)+2H2(g)△H2=﹢90.2KJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H3
(1)反应①△H1>0,在一定条件下,能自发进行的原因是△S>0;△H3=-41.1KJ•mol-1.
(2)已知800℃时:CO(g)+H2O(g)?CO2(g)+H2(g) K=1.0.在此温度下向一2L的恒温恒容密闭容器中充入2molH2O(g)和2molCO,2min后达到平衡,则平衡时CO2的物质的量浓度为;从反应开始至达到平衡时H2O的平均反应速率为0.25mol•L-1•min-1.
(3)900℃时,反应:CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数K< 1.0(填“>”“<”或“=”).
分析 (1)依据反应自发进行的依据是△H-T△S<0分析判断;热化学方程式可以结合盖斯定律计算得到;
(2)依据化学平衡三段式列式计算.结合反应速率计算得到,依据浓度改变平衡常数不变计算应用;
(3)依据(1)得到的热化学方程式可知反应是放热反应,升温平衡逆向进行.
解答 解:(1)自发进行的依据是△H-T△S<0,反应①C(s)+H20(g)=CO(g)+H2(g)△H=+131.3kJ/mol是吸热反应,△H>0,△S>0,所以反应自发进行是高温下进行的反应,依据盖斯定律,②-①得到,在相同条件下,CO与H2O(g)反应的热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H3=-41.1KJ/mol,故△H3=-41.1KJ/mol,
故答案为:△S>0;-41.1;
(2)依据化学平衡三段式列式,设反应达到平衡消耗水的物质的量为x
CO(g)+H2O(g)?C02(g)+H2(g)
起始量(mol) 2 2 0 0
变化量(mol) x x x x
平衡量(mol) 2-x 2-x x x
K=$\frac{\frac{x}{2}×\frac{x}{2}}{\frac{2-x}{2}×\frac{2-x}{2}}$=1
计算得到x=1mol,故n(C02)=1mol,c(C02)=$\frac{1mol}{2L}$=0.5mol/L,反应开始至达到平衡时的平均反应速率v(H2O)=$\frac{\frac{1mol}{2L}}{2min}$=0.25 mol•L-1•min-1,
故答案为:0.5mol/L; 0.25 mol•L-1•min-1;
(3)900℃时,依据题干反应可知反应是放热反应,升温平衡逆向进行,反应CO(g)+H2O(g)?C02(g)+H2(g)的平衡常数减小,K<1.0,
故答案为:<.
点评 本题考查了反应自发进行的判断依据,化学平衡的计算应用,平衡常数的分析判断,题目难度中等.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 为了使豆腐白嫩和富有弹性,制作时可使用吊白块(具有漂白性)和烧碱 | |
| B. | 金属Mg失火时不能用泡沫灭火器扑灭 | |
| C. | 土壤胶粒带负电荷,有利于铵态氮肥的吸收 | |
| D. | 水玻璃可用于生产黏合剂和防火剂 |
| A. | Y的氢化物比R的氢化物稳定,沸点高 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有6种 | |
| C. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
| A | B | C | D | E |
| A. | HnDOm为强酸时,E的非金属性一定很强 | |
| B. | A(OH)n为强碱时,B(OH)m也一定为强碱 | |
| C. | E元素的最高化合价为+7时,D元素的负化合价可为-2价 | |
| D. | HnCOm为强酸时,E的单质可能有强还原性 |
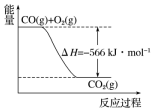 已知:
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式和图象判断,下列说法正确的是( )
| A. | CO的燃烧热为283kJ | |
| B. | 图可表示由1molCO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ•mol-1 | |
| D. | 根据以上热化学方程式无法求算Na2O2(s)+CO(g)═Na2CO3 (s) 的反应热 |
| 选项 | 规律 | 结论 |
| A | 同主族元素性质的相似性 | 钠和氧反应可以形成Na2O2,也可以和硫形成Na2S2 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片分别加入足量的稀硫酸和浓硫酸中,浓硫酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | H2O沸点低于H2S |
| D | 较强酸可以制取较弱酸 | 亚硫酸和次氯酸钙反应可以制取次氯酸 |
| A. | A | B. | B | C. | C | D. | D |

| A. | ①电子流动方向 | B. | ②电流方向 | ||
| C. | ③电极反应 | D. | ④溶液中离子移动方向 |
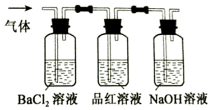 FeSO4受热分解的化学方程式为:2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+SO3↑
FeSO4受热分解的化学方程式为:2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+SO3↑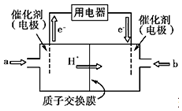 氢氧燃料电池的结构示意图如图所示,一极通入氢气,另外一极通入氧气;电解质溶液是稀硫酸.(图中:质子交换膜只允许H+通过)
氢氧燃料电池的结构示意图如图所示,一极通入氢气,另外一极通入氧气;电解质溶液是稀硫酸.(图中:质子交换膜只允许H+通过)