题目内容
草酸(H2C2O4)是二元弱酸,25℃时,H2C2O4:K1=5.4×10-2,K2=5.4×10-5;H2CO3:K1=4.5×10-7,K2=4.7×10-11.
(1)KHC2O4溶液呈 性(填“酸”、“中”或“碱”).
(2)下列化学方程式可能正确的是 .
A.H2C2O4+C
═HC
+HC2
B.HC2
+CO
=HCO
+C2
C.2C2O
+CO2+H2O=2HC2O
+CO
D.H2C2O4+CO
=C2O
+H2O+CO2↑
(3)常温下,向10mL 0.01mol?L-1H2C2O4溶液中滴加0.01mol?L-1的KOH溶液V mL,回答下列问题:
①当V<10时,反应的离子方程式为 .
②若溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),则pH 7(填“>”“<”或“=”),V 10(填“>”“<”或“=”).
③当溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-)+c(H2C2O4),则溶液中溶质为 ,V 10(填“>”、“<”或“=”).
④当V=20时,溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为 .
(1)KHC2O4溶液呈
(2)下列化学方程式可能正确的是
A.H2C2O4+C
| O | 2- 3 |
| O | - 3 |
| O | - 4 |
B.HC2
| O | 2- 3 |
2- 3 |
- 3 |
| O | 2- 4 |
C.2C2O
2- 4 |
- 4 |
2- 3 |
D.H2C2O4+CO
2- 3 |
2- 4 |
(3)常温下,向10mL 0.01mol?L-1H2C2O4溶液中滴加0.01mol?L-1的KOH溶液V mL,回答下列问题:
①当V<10时,反应的离子方程式为
②若溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),则pH
③当溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-)+c(H2C2O4),则溶液中溶质为
④当V=20时,溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用,离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)HC2O4- 电离程度大于水解程度;
(2)电离常数越大其酸性越强,根据强酸制取弱酸判断;
(3)①当V<10mL时,H2C2O4 和KOH反应生成HC2O4 -,还有草酸多余;
②根据电荷守恒确定溶液中氢离子和氢氧根离子浓度相对大小,从而确定溶液酸碱性;草酸氢钠溶液呈酸性,要使溶液呈中性,则氢氧化钠应该稍微过量;
溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),依据溶液中电荷守恒分析氢离子浓度和氢氧根离子浓度相同判断;
溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)是溶液中物料守恒分析,溶质为KHC2O4;
④当V=20mL时,恰好完全反应生成K2C2O4,C2O42-分步水解,越来越弱.
(2)电离常数越大其酸性越强,根据强酸制取弱酸判断;
(3)①当V<10mL时,H2C2O4 和KOH反应生成HC2O4 -,还有草酸多余;
②根据电荷守恒确定溶液中氢离子和氢氧根离子浓度相对大小,从而确定溶液酸碱性;草酸氢钠溶液呈酸性,要使溶液呈中性,则氢氧化钠应该稍微过量;
溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),依据溶液中电荷守恒分析氢离子浓度和氢氧根离子浓度相同判断;
溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)是溶液中物料守恒分析,溶质为KHC2O4;
④当V=20mL时,恰好完全反应生成K2C2O4,C2O42-分步水解,越来越弱.
解答:
解:(1)HC2O4- 的电离程度大于水解程度,故KHC2O4溶液显酸性,故答案为:酸性;
(2)根据电离常数知酸性强弱顺序是:H2C2O4>HC2O4->H2CO3>HCO3-,根据强酸制取弱酸知草酸和碳酸根离子反应生成草酸根离子和二氧化碳,草酸氢根离子和碳酸根离子反应生成碳酸氢根离子和草酸根离子,故选BD;
(3)①当V<10mL时,H2C2O4 和KOH反应生成HC2O4 -,还有草酸多余,反应的离子方程式为:H2C2O4+OH-=HC2O4-+H2O;
故答案为:H2C2O4+OH-=HC2O4-+H2O;
②根据电荷守恒得c(K+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-),c(K+)=2c(C2O42-)+c(HC2O4-),则c(H+)=c(OH-),所以溶液呈中性,pH=7;草酸氢钾溶液呈酸性,要使溶液呈中性,则氢氧化钠应该稍微过量,所以V(NaOH)>10mL,
故答案为:=;>;
③溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)是溶液中物料守恒分析,溶质为KHC2O4,说明V(NaOH)=10mL,
故答案为:KHC2O4,=;
④当V=20mL时,反应生成K2C2O4,C2O42-分步水解,越来越弱,故溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为c(C2O42-)>c(OH-)>c(HC2O4-)>c(H2C2O4),故答案为:c(C2O42-)>c(OH-)>c(HC2O4-)>c(H2C2O4).
(2)根据电离常数知酸性强弱顺序是:H2C2O4>HC2O4->H2CO3>HCO3-,根据强酸制取弱酸知草酸和碳酸根离子反应生成草酸根离子和二氧化碳,草酸氢根离子和碳酸根离子反应生成碳酸氢根离子和草酸根离子,故选BD;
(3)①当V<10mL时,H2C2O4 和KOH反应生成HC2O4 -,还有草酸多余,反应的离子方程式为:H2C2O4+OH-=HC2O4-+H2O;
故答案为:H2C2O4+OH-=HC2O4-+H2O;
②根据电荷守恒得c(K+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-),c(K+)=2c(C2O42-)+c(HC2O4-),则c(H+)=c(OH-),所以溶液呈中性,pH=7;草酸氢钾溶液呈酸性,要使溶液呈中性,则氢氧化钠应该稍微过量,所以V(NaOH)>10mL,
故答案为:=;>;
③溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)是溶液中物料守恒分析,溶质为KHC2O4,说明V(NaOH)=10mL,
故答案为:KHC2O4,=;
④当V=20mL时,反应生成K2C2O4,C2O42-分步水解,越来越弱,故溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为c(C2O42-)>c(OH-)>c(HC2O4-)>c(H2C2O4),故答案为:c(C2O42-)>c(OH-)>c(HC2O4-)>c(H2C2O4).
点评:本题考查弱电解质的电离、探究物质的组成及含量的测定、溶液中离子浓度大小比较方法等知识点,难度中等.

练习册系列答案
相关题目
一定量的盐酸跟过量的镁粉反应时,为了适当减缓反应速度,但不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体
②H2O
③铜屑
④CH3COONa固体
⑤NaNO3溶液.
①NaOH固体
②H2O
③铜屑
④CH3COONa固体
⑤NaNO3溶液.
| A、①② | B、②③④ |
| C、②③⑤ | D、②④ |
下列电离方程式错误的是( )
| A、HCl=H++Cl- | ||
B、Al(NO3)3=Al3++3NO
| ||
C、Na2CO3=2Na++CO
| ||
D、MgCl2=Mg2++Cl
|
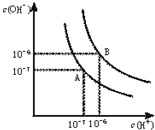 (1)水的电离平衡曲线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从
(1)水的电离平衡曲线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从
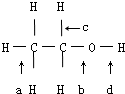 ,判断发生反应其所断裂的键.
,判断发生反应其所断裂的键.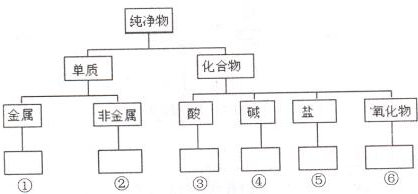 在化学研究中,化学家常常先对物质进行分类,以便对同类物质的组成和性能进行深入的研究,请你将下列物质N2、HClO、CuO、KOH、NaHCO3、Fe3O4、Mg、S的正确分类填入相应的方框内:
在化学研究中,化学家常常先对物质进行分类,以便对同类物质的组成和性能进行深入的研究,请你将下列物质N2、HClO、CuO、KOH、NaHCO3、Fe3O4、Mg、S的正确分类填入相应的方框内: