题目内容
仔细分析乙醇分子结构,有五种不同的共价键: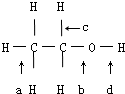 ,判断发生反应其所断裂的键.
,判断发生反应其所断裂的键.
(1)乙醇与浓硫酸共热到170℃:
(2)乙醇在铜催化下与氧气反应:
(3)乙醇,乙酸和浓硫酸混合受热: .
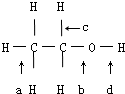 ,判断发生反应其所断裂的键.
,判断发生反应其所断裂的键.(1)乙醇与浓硫酸共热到170℃:
(2)乙醇在铜催化下与氧气反应:
(3)乙醇,乙酸和浓硫酸混合受热:
考点:乙醇的化学性质
专题:有机反应
分析:乙醇官能团为:-OH,可发生取代、氧化和消去反应,可与钠发生置换反应,结合官能团的性质和反应得到的产物的结构判断化学键的断裂方式,以此解答.
解答:
解:(1)乙醇与浓硫酸共热到170℃,发生消去反应生成乙烯,断裂a合b键,
故答案为:a和b;
(2)在铜催化共热下与O2反应生成乙醛,-CH2OH结构被氧化为-CHO结构,断裂c和d,
故答案为:c和d;
(3)在浓硫酸的催化共热下与乙酸反应生成乙酸乙酯,依据酯化反应的原理:酸去羟基,醇去氢,可知断裂键d,
故答案为:d.
故答案为:a和b;
(2)在铜催化共热下与O2反应生成乙醛,-CH2OH结构被氧化为-CHO结构,断裂c和d,
故答案为:c和d;
(3)在浓硫酸的催化共热下与乙酸反应生成乙酸乙酯,依据酯化反应的原理:酸去羟基,醇去氢,可知断裂键d,
故答案为:d.
点评:本题考查乙醇的结构和性质,难度度不大.注意把握有机物的官能团的性质和结构特点结合反应的原理及生成物的结构分析断键的位置.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下列变化过程,氧元素发生了还原反应的是( )
| A、HgO→O2 |
| B、H2O2→O2 |
| C、CuO→H2O |
| D、H2O2→H2O |
若某基态原子的外围电子排布式为3d14s2,则下列说法正确的是( )
| A、该元素基态原子中存在电子的原子轨道共有2个 |
| B、该元素原子核外有4个电子层 |
| C、该元素原子中运动状态不同的电子共有21种 |
| D、该元素原子M电子层共有18个电子 |
 实验室常用的浓盐酸物质的量浓度约为12.0mol?L-1.
实验室常用的浓盐酸物质的量浓度约为12.0mol?L-1.