题目内容
19.锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷.我国有丰富的锆英石(ZrSiO4)含Al2O3、SiO2、Fe2O3等杂质,碱熔法生产锆的流程如下: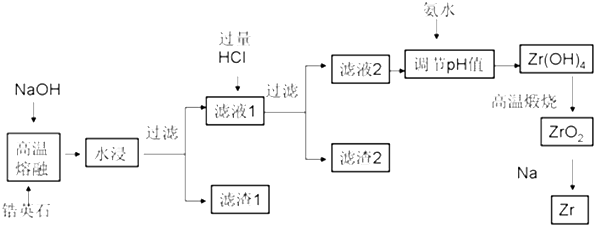
已知25℃时部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
ZrSiO4+4NaOH═Na2ZrO3+Na2SiO3+2H2O
(2)为了提高浸出率可采取的方法有原料粉碎增大接触面积、加热或搅拌或多次浸取(列举两种)
(3)生成滤渣2的成分H2SiO3或H4SiO4(用化学式表示)
(4)用氨水将滤液2的pH调至2.4≤pH<3.4,目的是使Zr4+完全转化为Zr(OH)4沉淀,同时保证Al3+不会被沉淀下来.
(5)往流程中滤渣1中加入盐酸溶液,过滤不溶物后,再将滤液在不断通入HCl气流中气流同时蒸发浓缩、冷却结晶、过滤,可回收得到铁的氯化物FeCl3晶体.
分析 锆英砂(主要成分为ZrSiO4,也可表示为ZrO2•SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)加NaOH熔融,二氧化硅反应转化为硅酸钠,ZrSiO4转化为Na2SiO3和Na2ZrO3,氧化铝和氢氧化钠反应生成偏铝酸钠,水浸过滤,滤渣1为Fe2O3,得到滤液1中加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,偏铝酸钠和过量盐酸反应得到氯化铝,滤渣2为H2SiO3,滤液中含有ZrO2+、Al3+,加氨水调节pH为2.4~2.7使ZrO2+转化为Zr(OH)4沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2;
(1)高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3;
(2)结合影响化学反应速率的因素分析,增大浓度、升高温度、增大接触面积、搅拌、多次浸取等分析;
(3)分析可知滤渣2为硅酸沉淀;
(4)根据表中数据判断;加氨水至pH=2.4时,ZrO2+与NH3•H2O反应生成Zr(OH)4沉淀;
(5)滤渣1为Fe2O3,加入盐酸溶液,制备氯化铁晶体时应防止铁离子水解,由溶液得到晶体,可进行蒸发浓缩、冷却结晶、过滤等操作.
解答 解:(1)高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3,反应的化学方程式为:ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O,
故答案为:ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O;
(2)为了提高浸出率可采取的方法有,将原料粉碎增大接触面积、加热、搅拌、多次浸取,
故答案为:原料粉碎增大接触面积、加热或搅拌或多次浸取;
(3)二氧化硅反应转化为硅酸钠,ZrSiO4转化为Na2SiO3和Na2ZrO3,氧化铝和氢氧化钠反应生成偏铝酸钠,水浸过滤,滤渣1为Fe2O3,得到滤液1中加过量盐酸酸浸,偏铝酸钠和过量盐酸反应得到氯化铝,Na2SiO3与HCl生成硅酸沉淀,滤渣2为H2SiO3或 H4SiO4,
故答案为:H2SiO3 或 H4SiO4;
(4)滤液2中含有ZrO2+、Al3+,依据图表数据分析可知,加氨水调节pH为2.4~2.7使ZrO2+转化为Zr(OH)4沉淀,铝离子不沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2;
故答案为:2.4≤pH<3.4;使Zr4+完全转化为Zr(OH)4沉淀,同时保证Al3+不会被沉淀下来;
(5)滤渣1为Fe2O3,加入盐酸溶液,过滤不溶物后得到滤液为氯化铁溶液,再将滤液在不断通入HCl气流中蒸发结晶,防止氯化铁水解生成氢氧化铁沉淀,同时蒸发浓缩、冷却结晶、过滤可回收得到铁的氯化物FeCl3晶体.
故答案为:HCl气流中;冷却结晶、过滤.
点评 本题考查了物质制备的流程,为高考常见题型.侧重于学生的分析能力和实验能力的考查,题目涉及混合物分离、提纯及化学方程式的方法、物质性质的应用,综合性较强,题目难度中等.

| A. | 2n(C)+n(N)+2 | B. | 2n(C)+2n(N)+n(O) | C. | 3n(C)+2n(O)+2 | D. | 2n(C)+2n(N)+2 |
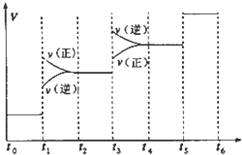 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.下列说法正确的是( )
| A. | 图中t1时引起平衡移动的条件可能是升高温度 | |
| B. | 表示平衡混合物中NH3的含量最高的一段时间是t5~t6 | |
| C. | 温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为$\frac{16}{{a}_{2}}$ | |
| D. | 在t2~t3时间段,保持容器体积不变,充入一定量的惰性气体,N2的浓度不变 |

| A. | 汽车尾气中有NOx,主要是汽车打火时氮气和氧气反应引起的 | |
| B. | 可以用图1所示装置收集到干燥的NO气体 | |
| C. | 根据图2装置收集到的气体为无色能够验证铜和稀硝酸反应的产物中气态物质只有NO | |
| D. | 可以用湿润的淀粉碘化钾试纸鉴别红棕色气体NO2和溴蒸气 |
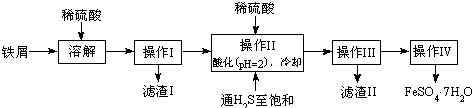
查询资料,得有关物质的数据如下表:
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其洗涤的目的是洗去晶体表面的硫酸等杂质;用冰水的原因是降低晶体的溶解度,减少溶解导致FeSO4•7H2O的损耗;
(3)次氯酸盐在碱性条件下氧化硫酸亚铁可得高冷净水剂K2FeO4,离子方程式为2ClO-+Fe2++4OH-=FeO42-+2Cl-+2H2O;
(4)25℃时,将FeSO4•7H2O样品溶于水配成FeSO4溶液,该溶液中的Fe2+在空气中易被氧化成Fe3+,若向完全被氧化后的溶液中滴加NaOH溶液,当滴至溶液的pH=4时,溶液中的c(Fe3+)=4.0×10-8mol/L.[已知该温度下,Fe(OH)3的Ksp=4.0×10-38]
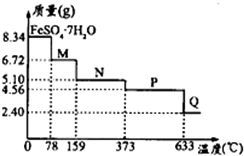
(5)将8.34gFeSO4•7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示:
①在100℃时M的化学式为FeSO4•4H2O;
②FeSO4•7H2O晶体中有3种不同结合力的水分子.
 甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )| A. | A2B3 | B. | A3B2 | C. | AB2 | D. | A2 |
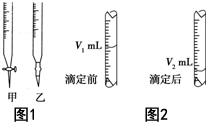 现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白: 清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.