题目内容
17.已知氮的氧化物具有氧化性,能与灼热的铜反应生成氧化铜和氮气.将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为( )| A. | N2O3 | B. | NO2 | C. | N2O | D. | N2O4 |
分析 氮氧化合物气体的物质的量为1mol,生成气体的物质的量为0.5mol,应为氮气,根据氮原子质量守恒可知应为NO2.
解答 解:氮氧化合物气体的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,生成气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,假设反应为:2NxOy+2yCu$\frac{\underline{\;\;△\;\;}}{\;}$2yCuO+xN2,
根据氮原子守恒可知x=1,应为NO2,即发生4Cu+2NO2=4CuO+N2.
故选B.
点评 本题考查氮氧化物的知识,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,侧重于阿伏伽德罗定律的考查,可运用质量守恒定律解答该题.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
5.如图为农夫山泉矿泉水瓶上的部分说明文字,列出了饮用天然水理化指标,这里的钙、钾、钠是指( )

| A. | 原子 | B. | 分子 | C. | 单质 | D. | 元素 |
12.下列有关离子方程式书写正确的是( )
| A. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HC1O | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将1 mol•L-1NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ |
9.下列说法不正确的是( )
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,等pH的CH3COONa、NaHCO3、NaClO三种溶液的浓度大小关系为c(NaClO)>c(NaHCO3)>c(CH3COONa) |
7.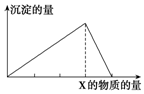 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | AlO2- | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |