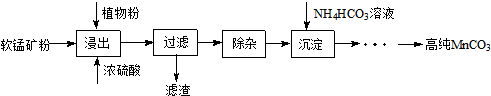
题目内容
7.焦亚硫酸钠(Na2S2O5)和硫代硫酸钠(Na2S2O3)在工业上有广泛的应用,例如焦亚硫酸钠是常用的食品抗氧化剂之一.实验室可用如图1夹持仪器)模拟其生成过程.
Ⅰ.选用②③④装置来制备焦亚硫酸钠.
(1)仪器A的名称是圆底烧瓶.
(2)写出装置③中发生反应的化学方程式:Na2SO3+SO2=Na2S2O5.
(3)装置④的作用是:吸收多余的二氧化硫同时防止倒吸.
Ⅱ.硫代硫酸钠(Na2S2O3)可用作分析试剂及鞣革的还原剂,其实验室的制备原理为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
(4)依据硫代疏酸钠的制备原理,从上述仪器中择合适的实验仪器,根据气流由左至右的顺序是②①④.(填序号)
(5)写出装置②中反应的离子方程式:SO32-+2H+=SO2↑+H2O.
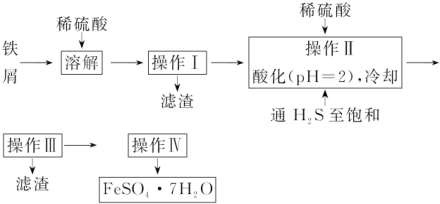
(6)实验室用Na2S2O3标准液测量废水中Ba2+的浓度,过程如下

已知:2S2O32-+I2═S4O62-+2I-
①滴定过程中选择的指示剂是:淀粉溶液.
②若滴定前尖嘴没有气泡,滴定终点有气泡,则测得结果:偏低. (填“偏高”“偏低”或“不变”).若标准液Na2S2O3的浓度为0.1000moL•L-1,滴定前后该溶液的读数如图2则废水中Ba2+的物质的量浓度为:0.0364mol/L.
分析 Ⅰ.根据装置图可知仪器A的名称;选用②③④装置来制备焦亚硫酸钠,用装置②制取二氧化硫,装置③是二氧化硫与亚硫酸钠反应生成焦亚硫酸钠,装置④是用高锰酸钾溶液吸收二氧化硫尾气,防止污染空气,同时注意防止倒吸,据此答题;
Ⅱ.依据硫代硫酸钠的制备原理,用装置②制取二氧化硫,在装置①中用硫化钠、碳酸钠、二氧化硫气体反应生成硫代硫酸钠,装置④为尾气吸收装置,吸收二氧化硫和硫化氢等酸性气体,据此答题;
(6)实验室用Na2S2O3标准液测量废水中Ba2+的浓度,先在废水中加入足量的K2CrO4使钡离子生成BaCrO4,过滤后,用HI还原BaCrO4,生成I2,再用Na2S2O3标准液滴定生成的I2、根据消耗的Na2S2O3的物质的量可计算出废水中Ba2+的物质的量浓度.
解答 解:Ⅰ.(1)根据装置图可知仪器A的名称为圆底烧瓶,
故答案为:圆底烧瓶;
(2)根据上面的分析可知,装置③是二氧化硫与亚硫酸钠反应生成焦亚硫酸钠,发生反应的化学方程式为:Na2SO3+SO2=Na2S2O5,
故答案为:Na2SO3+SO2=Na2S2O5;
(3)装置④是用高锰酸钾溶液吸收二氧化硫尾气,防止污染空气,同时能防止倒吸,
故答案为:吸收二氧化硫尾气,防止污染空气,同时能防止倒吸;
Ⅱ.(4)依据硫代硫酸钠的制备原理,用装置②制取二氧化硫,在装置①中用硫化钠、碳酸钠、二氧化硫气体反应生成硫代硫酸钠,装置④为尾气吸收装置,吸收二氧化硫和硫化氢等酸性气体,所以根据气流由左至右的顺序是②①④,
故答案为:②①④;
(5)装置②用浓硫酸与亚硫酸钠反应制取二氧化硫,反应的离子方程式为SO32-+2H+=SO2↑+H2O,
故答案为:SO32-+2H+=SO2↑+H2O;
(6)①根据上面的分析可知,在滴定时,是用Na2S2O3标准液滴定生成的I2,所以可以用淀粉溶液作指示剂,
故答案为:淀粉溶液;
②若滴定前尖嘴没有气泡,滴定终点有气泡,则读出的标准溶液的体积偏低,所以会使则测得结果偏低,滴定前后该溶液的读数如图2,则标准溶液的体积为27.6mL-0.3mL=27.3mL,标准液Na2S2O3的浓度为0.1000moL•L-1,则的物质的量为27.3mL×0.1000moL•L-1=2.73×10-3 mol,根据电子得失守恒及题中信息可得关系式Ba2+~BaCrO4~$\frac{3}{2}$I2~3Na2S2O3,所以废水中Ba2+的物质的量浓度为$\frac{2.73×1{0}^{-3}×\frac{1}{3}mol}{25.00×1{0}^{-3}L}$=0.0364mol/L,
故答案为:偏低;0.0364mol/L.
点评 本题考查了物质制备方案设计,题目难度中等,注意掌握浓硫酸、铜的化合物、单质碘等物质的性质,明确性质实验方案设计的方法,明确题中资料信息是解题根据,试题培养了学生的分析、理解能力.

| A. | 1 L水中含有1 mol H2SO4 | |
| B. | 1 L溶液中含有1 mol H+ | |
| C. | 将98 g H2SO4溶于1 L水中配成溶液 | |
| D. | 1 L H2SO4溶液中含98 g H2SO4 |
| A. | 加热蒸干Na2CO3溶液,最后可以得到NaOH和Na2CO3的混合固体 | |
| B. | 除去MgCl2中的Fe3+,可以加入NaOH固体 | |
| C. | 明矾净水的反应:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| D. | 加热蒸干KCl溶液,最后得到KOH固体(不考虑CO2的反应) |
| A. | SO2、SiO2、CO2均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、四氯化碳、氨气均为电解质 | |
| D. | 福尔马林、水玻璃、氢氟酸、小苏打均为纯净物 |