题目内容
12.下列有关离子方程式书写正确的是( )| A. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HC1O | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将1 mol•L-1NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ |
分析 A.发生氧化还原反应生成氢氧化铁;
B.漏写亚硫酸氢根离子与碱的反应;
C.反应生成硫酸钡、硫酸钠和水;
D.1:1反应生成氢氧化铝,1:4反应生成偏铝酸钠,1 mol•L-1NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合,物质的量为1:1.5,则生成氢氧化铝和氯化铝.
解答 解:A.NaClO溶液与FeCl2溶液混合的离子反应为2Fe2++5ClO-+5H2O═2Fe(OH)3↓+Cl-+4HClO,故A错误;
B.NH4HSO3溶液与足量NaOH溶液反应的离子反应为HSO3-+NH4++2OH-═NH3↑+SO32-+2H2O,故B错误;
C.NaHSO4溶液与Ba(OH)2溶液反应至中性的离子反应为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故C正确;
D.将1 mol•L-1NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合的离子反应为6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
17.已知氮的氧化物具有氧化性,能与灼热的铜反应生成氧化铜和氮气.将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为( )
| A. | N2O3 | B. | NO2 | C. | N2O | D. | N2O4 |
4.反应速率v和反应物浓度的关系是用实验方法测定的,化学反应:H2+Cl2=2HCl的反应速率v可表示为:v=k[c(H2)]m•[c(Cl2)]n,k为常数,m,n值可用表中的数据确定
由此可推断m,n值正确的是( )
| v(mol•L-1•s-1) | c(H2)(mol•L-1) | c(Cl2)(mol•L-1) |
| 1.0k | 1.0 | 1.0 |
| 2.0k | 2.0 | 1.0 |
| 4.0k | 2.0 | 4.0 |
| A. | m=1,n=1 | B. | m=$\frac{1}{2}$,n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$,n=1 | D. | m=1,n=$\frac{1}{2}$ |
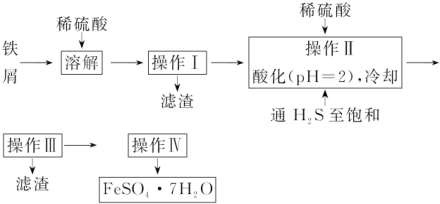
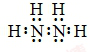 .
. Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过l0s达平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过l0s达平衡,测得平衡时NH3的物质的量为0.8mol. 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.