题目内容
下列推论正确的是( )
| A、H2(g)的燃烧热是285.8 kJ?mol-1,则H2O(g)=2H2(g)+O2(g)△H=+285.8 kJ?mol-1 |
| B、对于反应2H2O2═2H2O+O2↑,升高温度能加快O2的生成速率 |
| C、已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| D、在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl-?[CuCl4]2-(绿)+4H2O,若向溶液中滴加足量AgNO3溶液,可使溶液呈现绿色 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、燃烧热是指1mol可燃物燃烧生成稳定化合物时放出的热量,H生成液态水;
B、升温能够加快反应速率;
C、燃烧都是放热反应,焓变小于0;
D、AgNO3能够反应掉氯离子使溶液变蓝色.
B、升温能够加快反应速率;
C、燃烧都是放热反应,焓变小于0;
D、AgNO3能够反应掉氯离子使溶液变蓝色.
解答:
解:A、H2(g)的燃烧热是285.8 kJ?mol-1,则H2O(l)=2H2(g)+O2(g)△H=+285.8 kJ?mol-1,故A错误;
B、升温能够加快反应速率,故B正确;
C、燃烧都是放热反应,焓变小于0,C完全燃烧放热多,所以△H1<△H2,故C错误;
D、AgNO3能够反应掉氯离子使溶液变蓝色,故D错误;
故选B.
B、升温能够加快反应速率,故B正确;
C、燃烧都是放热反应,焓变小于0,C完全燃烧放热多,所以△H1<△H2,故C错误;
D、AgNO3能够反应掉氯离子使溶液变蓝色,故D错误;
故选B.
点评:本题考查了燃烧热、温度对化学反应速率的影响、平衡移动,题目难度中等.

练习册系列答案
相关题目
将15g金属混合物粉末投入足量稀H2SO4中,充分反应后得到11.2L H2(在标准状况下),此金属混合物可能组成是( )
| A、Zn、Ag |
| B、Cu、Fe |
| C、Al、Fe |
| D、Mg、Al |
下列各项中离子方程式的书写与反应物的用量无关的是( )
| A、AlCl3溶液与稀氨水 |
| B、FeBr2溶液与Cl2 |
| C、CO2与Na2SiO3溶液 |
| D、澄清石灰水与Ca(HCO3)2溶液 |
贴有下列危险品标志的药品起火时,不能用水灭火的是( )
A、 |
B、 |
C、 |
D、 |
反应A(g)+2B(g)═C(g)的反应过程中能量变化如图所示.下列相关说法正确的是( )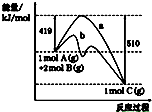

| A、正反应活化能大于逆反应活化能 |
| B、曲线b表示使用催化剂后的能量变化 |
| C、由图可知该反应的焓变△H=+91 kJ?mol-1 |
| D、反应中将气体A换为固体反应,其他条件不变,反应放出热量小于91kJ |
下列说法或表示方法正确的是( )
| A、催化剂能降低正反应的活化能,但不能改变逆反应的活化能 |
| B、在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C、由C(石墨)→C(金刚石);△H=+73 kJ/mol,可知金刚石比石墨稳定 |
| D、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
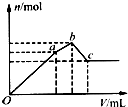 向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )
向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )| A、a点的沉淀总物质的量为0.03mol |
| B、Oa段发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、ab段发生反应的离子方程式是:2NH42++SO42-+Ba2++2OH-═2NH3?H2O+BaSO4↓ |
| D、反应到c点时,加入Ba(OH)2溶液的总体积为250mL |