题目内容
19.现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-.为确认溶液组成进行如下实验:(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)向(1)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
分析 (1)取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成,说明白色沉淀为BaCO3和BaSO4,质量一共是4.3g,则溶液中含有CO32-、SO42-,向沉淀中加入过量的盐酸,有2.33g沉淀不溶,则硫酸钡的质量是2.33g,所以硫酸根离子的物质的量是$\frac{2.33g}{233g/mol}$=0.01mol;碳酸钡的质量是:4.3g-2.33g=1.97g,碳酸根离子的物质的量为:$\frac{1.97g}{197g/mol}$=0.01mol;
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体是氨气,物质的量是$\frac{11.2L}{22.4L/mol}$=0.05mol,说明溶液中有NH4+的物质的量是0.05mol,据此进行解答.
解答 解:(1)取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成,说明白色沉淀为BaCO3和BaSO4,质量一共是4.3g,则溶液中含有CO32-、SO42-,向沉淀中加入过量的盐酸,有2.33g沉淀不溶,则硫酸钡的质量是2.33g,所以硫酸根离子的物质的量是$\frac{2.33g}{233g/mol}$=0.01mol;碳酸钡的质量是:4.3g-2.33g=1.97g,碳酸根离子的物质的量为:$\frac{1.97g}{197g/mol}$=0.01mol;
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体是氨气,物质的量是$\frac{11.2L}{22.4L/mol}$=0.05mol,说明溶液中有NH4+的物质的量是0.05mol,
A.根据分析可知,溶液一定存在的离子有:CO32-、SO42-、NH4+,可能存在的离子有:Cl-、K+、Na+,故A正确;
B.根据A可知,溶液中K+、Na+,故B错误;
C.依据计算得出c(CO32-)=$\frac{0.01mol}{0.2L}$=0.05mol/L,硫酸根为0.01mol,铵根为0.05mol,故c(NH4+)>c(SO42-),故C错误;
D.依据溶液电中性原则,假设都存在,那么n(+)=n(-),即0.05+n(Na+)+n(K+)=2×0.01+2×0.01+n(Cl-),据此得出n(Cl-)=n(Na+)+n(K+)+0.01>0.01=n(SO42-),则c(Cl-)>c(SO42-),故D正确;
故选AD.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题培养了学生的分析能力及灵活应用能力.

 口算题天天练系列答案
口算题天天练系列答案| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
| A. | 大于10.00mL | B. | 小于10.00Ml | C. | 等于10.00mL | D. | 不能确定 |
| A. | 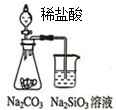 如图可能证明非金属性强弱:Cl>C>Si | |
| B. | 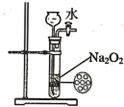 如图装置可用来制备少量氧气,并且控制反应的发生与停止 | |
| C. | 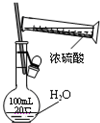 图中配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行 | |
| D. | 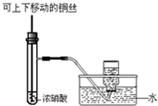 如图为制备并收集少量NO2气体 |
| A. | PH值一定为5 | B. | 一定是酸溶液 | ||
| C. | 可能是强酸的酸式盐溶液 | D. | PH值可能为9 |
| A. | 盐酸中逐滴加入食盐溶液 | B. | 硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 石灰乳中滴加稀盐酸 | D. | 硫酸中逐滴加入氢氧化钡溶液 |
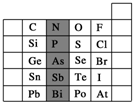 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.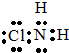 ,从物质结构的角度解释两者熔点相差较大的原因氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,熔沸点离子晶体高于分子晶体.
,从物质结构的角度解释两者熔点相差较大的原因氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,熔沸点离子晶体高于分子晶体. 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: