题目内容
14.下列图中所示的实验操作评价合理的是( )| A. | 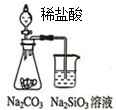 如图可能证明非金属性强弱:Cl>C>Si | |
| B. | 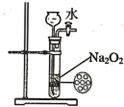 如图装置可用来制备少量氧气,并且控制反应的发生与停止 | |
| C. | 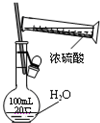 图中配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行 | |
| D. | 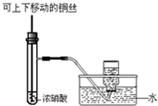 如图为制备并收集少量NO2气体 |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
B.过氧化钠是粉末状固体;
C.容量瓶不能稀释或溶解药品;
D.浓硝酸和铜反应生成二氧化氮,二氧化氮和水反应生成硝酸和NO.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,HCl不是Cl元素的最高价氧化物的水化物,所且元素易挥发导致生成的二氧化碳中含有HCl,HCl和硅酸钠反应影响二氧化碳的反应,所以不能据此判断非金属性强弱,故A错误;
B.过氧化钠是粉末状固体,所以不能用简易启普发生器、过氧化钠和水制取氧气,故B错误;
C.容量瓶不能稀释或溶解药品,应该将浓硫酸在烧杯中稀释,冷却至室温后再转移到容量瓶中,故C正确;
D.浓硝酸和铜反应生成二氧化氮,二氧化氮和水反应生成硝酸和NO,应该采用排空气法收集二氧化氮,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及气体制备、收集、溶液配制、非金属性强弱判断,明确实验原理、物质性质是解本题关键,易错选项是A,注意盐酸的挥发性、非金属性强弱判断方法,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
3.化学与人类生产和生活密切相关,下列说法正确的是( )
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 加碘食盐中加入的I2有利于防止地方缺碘病 | |
| C. | 二氧化硫有漂白性,常用作棉、麻、纸张的漂白 | |
| D. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 |
5.如表是周期表的一部分,请回答有关问题.
(1)①原子结构示意图是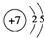 ,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.
,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.
(2)原子半径③>④,金属性③>④,(填“>”或“<”)
(3)②和⑦形成的化合物中,能使品红溶液腿色的是SO2(填化学式),它对环境的主要危害是形成酸雨,⑦、⑧元素形成的氢化物热稳定性较强的是HCl(填化学式).
(4)写出③与水反应的化学方程式2Na+2H2O═H2↑+2NaOH.
| ⅠA | ⅡA | ⅢA | Ⅳ | ⅤA | ⅥA | ⅦA | 0 | |
| 二周期 | ① | ② | | |||||
| 三周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
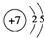 ,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.
,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.(2)原子半径③>④,金属性③>④,(填“>”或“<”)
(3)②和⑦形成的化合物中,能使品红溶液腿色的是SO2(填化学式),它对环境的主要危害是形成酸雨,⑦、⑧元素形成的氢化物热稳定性较强的是HCl(填化学式).
(4)写出③与水反应的化学方程式2Na+2H2O═H2↑+2NaOH.
2.常温下,下列事实可证明氨水是弱碱的是( )
| A. | 氨水能跟氯化铁溶液反应生成氢氧化铁 | |
| B. | 铵盐受热易分解 | |
| C. | 0.1 mol/L氯化铵溶液的pH约为5 | |
| D. | 0.1 mol/L氨水可使酚酞试液变红 |
9.下列化学方程式或离子方程式正确的是( )
| A. | FeS加入稀硫酸溶液中:FeS+2H+═Fe2++H2S↑ | |
| B. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 铜片跟浓硝酸反应:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O | |
| D. | 酸性KMnO4溶液中滴加H2O2:2MnO4-+H2O2+6H+═2Mn2++3O2↑+4H2O |
19.现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-.为确认溶液组成进行如下实验:
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)向(1)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)向(1)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
6.在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:Cu2++SO42-+x H2O?CuSO4•xH2O,当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是( )
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目增大 | ||
| C. | 该硫酸铜晶体体积不变 | D. | 溶液的蓝色不变 |
4.如表为元素周期表中的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题.
(1)化学性质最不活泼的元素是氩(填名称).
(2)元素①的单质在氧气中燃烧,生成的氧化物的化学式是CO2.
(3)第3周期主族元素中,元素原子半径最小的是Cl(填元素符号).
(4)元素⑨的单质和石灰乳作用可制取漂白粉,该反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(5)元素④的原子最外层电子数为7.
(6)元素⑦的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称).
(7)元素⑧、⑨中,化学性质较不活泼的元素是S(填元素符号),氢化物较稳定的是HCl(填化学式).
(8)元素②的氢化物化学式NH3,元素⑨的最高价氧化物的水化物的化学式HClO4
(9)元素⑤的氢氧化物和稀盐酸反应的化学方程式NaOH+HCl=NaCl+H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素①的单质在氧气中燃烧,生成的氧化物的化学式是CO2.
(3)第3周期主族元素中,元素原子半径最小的是Cl(填元素符号).
(4)元素⑨的单质和石灰乳作用可制取漂白粉,该反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(5)元素④的原子最外层电子数为7.
(6)元素⑦的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称).
(7)元素⑧、⑨中,化学性质较不活泼的元素是S(填元素符号),氢化物较稳定的是HCl(填化学式).
(8)元素②的氢化物化学式NH3,元素⑨的最高价氧化物的水化物的化学式HClO4
(9)元素⑤的氢氧化物和稀盐酸反应的化学方程式NaOH+HCl=NaCl+H2O.
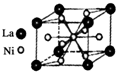 目前,利用金属或合金储氢已取得很大进展,先后发现了Ni、Mg、Fe基三个系列的储氢材料,如图是一种储氢密度超过液氢的镍基合金的晶胞结构图.
目前,利用金属或合金储氢已取得很大进展,先后发现了Ni、Mg、Fe基三个系列的储氢材料,如图是一种储氢密度超过液氢的镍基合金的晶胞结构图.