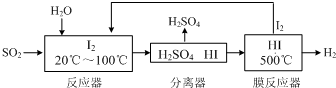
题目内容
7.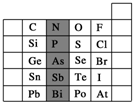 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.(1)阴影部分元素P在元素周期表中的位置为第三周期ⅤA族.根据元素周期律,预测:酸性强弱H3PO4> H3AsO4.(用“>”“<”或“=”表示)
(2)已知阴影部分As元素的原子核内质子数为33,则Sn2+的核外电子数为48.
(3)下列说法正确的是B.
A.C、N、O、F的原子半径随着原子序数的增大而增大
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.对于短周期元素,两种简单离子不可能相差3个电子层
D.HF、HCl、HBr、HI的还原性依次减弱.
分析 (1)由P元素在周期表中的位置可知,处于第三横行、15列;同主族自上而下,非金属性减弱,非金属性越强,最高价含氧酸的酸性越弱;
(2)As元素的原子核内质子数为33,则Sn原子序数为33-1+18=50,阳离子核外电子数=质子数-电荷数;
(3)A.同周期自左而右原子半径减小;
B.同周期自左而右非金属性增强;
C.对于短周期元素,两种简单离子可能相差3个电子层,如H+与S2-、Cl-;
D.非金属性越强,氢化物还原性越弱.
解答 解:(1)由P元素在周期表中的位置可知,处于第三横行、15列,故N元素处于第二周期ⅤA族;
同主族从上到下非金属性减弱,则最高价含氧酸的酸性越弱,则酸性H3PO4>H3AsO4,
故答案为:第三周期ⅤA族;>;
(2)As元素的原子核内质子数为33,则Sn原子序数为33-1+18=50,Sn2+的核外电子数为50-2=48,
故答案为:48;
(3)A.同周期自左而右原子半径减小,故C、N、O、F的原子半径随着原子序数的增大而减小,故A错误;
B.同周期自左而右非金属性增强,故Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强,故B正确;
C.对于短周期元素,两种简单离子可能相差3个电子层,如H+与S2-、Cl-,故C错误;
D.非金属性F>Cl>Br>I,非金属性越强,氢化物还原性越弱,HF、HCl、HBr、HI的还原性依次增强,故D错误,
故选:B.
点评 本题考查位置结构性质的关系及应用,难度不大,注意对元素周期律的理解掌握,理解掌握同主族原子序数关系.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
18.第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物
(1)下列叙述正确的是AD
A.HCHO与水分子之间能形成氢键
B.HCHO和CO2分子中的中心原子均采用SP2杂化
C.苯分子中含有6个σ键和1个大π键,苯是非极性分子
D.CO2晶体的熔点、沸点比二氧化硅晶体的低
(2)Mn和Fe部分电力能数据如表:
Mn元素的价电子排布式为3d54s2,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少
(3)铁原子核外有26种运动状态不同的电子.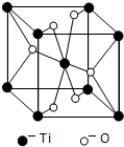
(4)根据元素电子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于d区
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为TiO2
(6)电镀厂排放的废水中常含有剧毒的CN-离子.可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2
①H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O
②与CNO-互为等电子体微粒的化学式为CO2、N2O、SCN-等(写一种即可)
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,写出氰酸的结构式:N≡C-O-H.
(1)下列叙述正确的是AD
A.HCHO与水分子之间能形成氢键
B.HCHO和CO2分子中的中心原子均采用SP2杂化
C.苯分子中含有6个σ键和1个大π键,苯是非极性分子
D.CO2晶体的熔点、沸点比二氧化硅晶体的低
(2)Mn和Fe部分电力能数据如表:
| 元素 | Mn | Fe | |
| 电离能/mol | I1 | 717 | 758 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)铁原子核外有26种运动状态不同的电子.

(4)根据元素电子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于d区
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为TiO2
(6)电镀厂排放的废水中常含有剧毒的CN-离子.可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2
①H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O
②与CNO-互为等电子体微粒的化学式为CO2、N2O、SCN-等(写一种即可)
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,写出氰酸的结构式:N≡C-O-H.
2.常温下,下列事实可证明氨水是弱碱的是( )
| A. | 氨水能跟氯化铁溶液反应生成氢氧化铁 | |
| B. | 铵盐受热易分解 | |
| C. | 0.1 mol/L氯化铵溶液的pH约为5 | |
| D. | 0.1 mol/L氨水可使酚酞试液变红 |
19.现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-.为确认溶液组成进行如下实验:
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)向(1)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)向(1)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) |