题目内容
11.在某一电解质溶液中逐滴加入另一溶液时,溶液的导电性由大变小,至不能导电后又逐渐增大的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 石灰乳中滴加稀盐酸 | D. | 硫酸中逐滴加入氢氧化钡溶液 |
分析 溶液的导电性和自由移动离子的浓度大小有关,若向某一电解质溶液中逐滴加入另一溶液时,加入物质能与溶液中电解质反应生成弱电解质或沉淀,溶液中电解质的浓度降低,不导电说明完全反应时溶液电荷浓度接近0,当另一溶液过量时,溶液中电荷浓度逐渐增大,又逐渐增强.
解答 解:A.HCl是强电解质,在水溶液里完全电离,加入NaCl后,二者不反应,溶液中电荷浓度不是0,所以不会不导电,故A错误;
B.硫酸和NaOH都是强电解质,二者发生反应H2SO4+2NaOH=Na2SO4+H2O,生成的硫酸钠是强电解质,溶液中离子浓度减小,所以导电能力减弱,但不会出现不导电的情况,故B错误;
C.石灰乳和盐酸反应生成氯化钙和水,导电能力增加,但是不会出现不能导电的情况,故C错误;
D.硫酸和氢氧化钡都是强电解质,二者发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,反应后生成难溶物和弱电解质,溶液中离子浓度逐渐减小,溶液的导电性由大变小,二者恰好反应时离子浓度最小,不导电,再继续滴加氢氧化钡,溶液中离子浓度增大,导电能力会增加,符合题意,故D正确;
故选D.
点评 本题考查电解质的电离及离子反应,明确溶液导电性与离子浓度关系是解本题关键,溶液导电性与离子浓度、电荷有关,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
1. 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:
(1)如果将4mol NH3 和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为80%.
4NH2(g)+5O2(g)?4NO(g)+6H2O(g)△H=-akJ•mol-1(a>0)
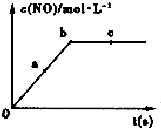
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a 正)、v(b 逆)、v(c 正)的大小关系是v(a正)>v(b逆)=v(c正).
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如表:
①第2min 到第4min,反应速率v(O2)=0.75mol/(L.min);
②第2min 时改变了条件,改变的条件可能是D(从所给选项中选择);
A.降低温度 B.增加了生成物 C.减小压强 D.使用了高效催化剂
③在与第4min 相同的温度下,若起始向容器中加入NH3、O2、NO 和H2O(g)的浓度都为2moI/L,则该反应正反应方向进行(填“正反应方向进行”、“逆反应方向进行”、“不移动”).
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为CO(NH2)2+NO+NO2$\frac{\underline{\;70-95℃\;}}{\;}$N2+CO2+2H2O.
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kj•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kj•mol-1
则1mol 甲烷直接将NO2 还原为N2的焓变为△H=-867kJ•mol-1.
 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:(1)如果将4mol NH3 和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为80%.
4NH2(g)+5O2(g)?4NO(g)+6H2O(g)△H=-akJ•mol-1(a>0)
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a 正)、v(b 逆)、v(c 正)的大小关系是v(a正)>v(b逆)=v(c正).
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如表:
| 深度/mol•L-1 时间/min | C(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
②第2min 时改变了条件,改变的条件可能是D(从所给选项中选择);
A.降低温度 B.增加了生成物 C.减小压强 D.使用了高效催化剂
③在与第4min 相同的温度下,若起始向容器中加入NH3、O2、NO 和H2O(g)的浓度都为2moI/L,则该反应正反应方向进行(填“正反应方向进行”、“逆反应方向进行”、“不移动”).
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为CO(NH2)2+NO+NO2$\frac{\underline{\;70-95℃\;}}{\;}$N2+CO2+2H2O.
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kj•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kj•mol-1
则1mol 甲烷直接将NO2 还原为N2的焓变为△H=-867kJ•mol-1.
2.常温下,下列事实可证明氨水是弱碱的是( )
| A. | 氨水能跟氯化铁溶液反应生成氢氧化铁 | |
| B. | 铵盐受热易分解 | |
| C. | 0.1 mol/L氯化铵溶液的pH约为5 | |
| D. | 0.1 mol/L氨水可使酚酞试液变红 |
19.现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-.为确认溶液组成进行如下实验:
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)向(1)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)向(1)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
6.在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:Cu2++SO42-+x H2O?CuSO4•xH2O,当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是( )
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目增大 | ||
| C. | 该硫酸铜晶体体积不变 | D. | 溶液的蓝色不变 |
20.某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法正确的是( )

| A. | 正极反应为Cl2+2e-=2Cl- | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.01 mol离子 |
1.相同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液的体积比是1:1:1,则三种溶液中氯离子的物质的量之比为( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 1:1:1 | D. | 6:3:2 |
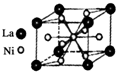 目前,利用金属或合金储氢已取得很大进展,先后发现了Ni、Mg、Fe基三个系列的储氢材料,如图是一种储氢密度超过液氢的镍基合金的晶胞结构图.
目前,利用金属或合金储氢已取得很大进展,先后发现了Ni、Mg、Fe基三个系列的储氢材料,如图是一种储氢密度超过液氢的镍基合金的晶胞结构图.