题目内容
14.有机物X、Y均为重要的工业原料,可由A和环己烯(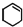 )为原料合成,路线如下(部分反应条件略):
)为原料合成,路线如下(部分反应条件略):
已知:ⅰ.X的结构简式是:

ⅱ.

ⅲ.

(1)X中含氧官能团的名称是酯基.
(2)A的化学式是C2H4O.
(3)任选1种具有反式结构的C的同系物,用结构简式表示其反式结构:
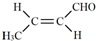 .
.(4)下列关于G和H的说法正确的是ab(选填字母).
a.用金属钠可以区别G和H
b.G、H经一步反应都可得到环己烯
c.H与苯酚具有相似的化学性质
d.试剂a是浓硫酸
(5)反应②、③、④、⑤中与反应①的类型相同的是③、④.
(6)Y的结构简式是
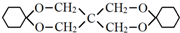 .
.(7)A→E的化学方程式是
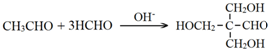 .
.
分析 根据X的结构简式和D的分子式可知,D为CH2=CHCOOH,F为C(CH2OH)4,根据转化关系A发生信息Ⅱ中的反应生成E,E发生加成反应生成F,所以A为CH3CHO,E为(CH2OH)3CCHO,根据D的结构简式可逆推得A与甲醛发生信息Ⅱ中的反应生成B为HOCH2CH2CHO,B发生消去反应生成C为CH2=CHCHO,C发生氧化反应得D,环已烯与溴化氢加成得G为1-溴环已烷,G发生碱性水解得H为环已醇,环已醇发生氧化反应得环已酮,根据Y的分子式可知,环已酮与F发生信息Ⅲ中的反应得Y为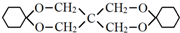 ,据此答题.
,据此答题.
解答 解:根据X的结构简式和D的分子式可知,D为CH2=CHCOOH,F为C(CH2OH)4,根据转化关系A发生信息Ⅱ中的反应生成E,E发生加成反应生成F,所以A为CH3CHO,E为(CH2OH)3CCHO,根据D的结构简式可逆推得A与甲醛发生信息Ⅱ中的反应生成B为HOCH2CH2CHO,B发生消去反应生成C为CH2=CHCHO,C发生氧化反应得D,环已烯与溴化氢加成得G为1-溴环已烷,G发生碱性水解得H为环已醇,环已醇发生氧化反应得环已酮,根据Y的分子式可知,环已酮与F发生信息Ⅲ中的反应得Y为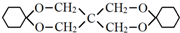 ,
,
(1)根据X的结构简式可知,X中含氧官能团的名称是 酯基,
故答案为:酯基;
(2)A为CH3CHO,A的化学式是 C2H4O,
故答案为:C2H4O;
(3)C为CH2=CHCHO,C的同系物,用结构简式表示其反式结构为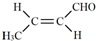 ,
,
故答案为: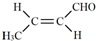 ;
;
(4)G为1-溴环已烷,H为环已醇,
a.H中有羟基能与钠生成气体,而G中没有,所以可以用金属钠可以区别G和H,故a正确;
b.G、H经消去反应都可得到环己烯,故b正确;
c.H是醇与苯酚的化学性质不相似,故c错误;
d.卤代烃的消去反应在氢氧化钠醇溶液中进行,所以试剂a是氢氧化钠醇溶液,故d错误;
故选a b;
(5)根据上面的分析可知,①为加成反应,③、④也为加成反应,所以反应②、③、④、⑤中与反应①的类型相同的是 ③、④,
故答案为:③、④;
(6)根据上面的分析可知,Y的结构简式是 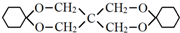 ,
,
故答案为: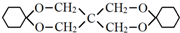 ;
;
(7)A→E的化学方程式是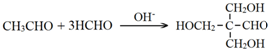 ,
,
故答案为: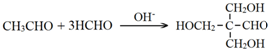 .
.
点评 本题考查有机物的推断,需要学生对给予的信息进行利用,能较好的考查学生的自学能力,利用正推法与逆推法相结合进行推断,需要熟练掌握官能团的性质,难度中等.

| A. | 甲基-CH3 | B. | 羟基-OH- | C. | 醛基-CHO | D. | 羧基-COOH |
(1)试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液.
查阅资料得知:淀粉遇I2变蓝.
请帮助他们完成以下实验报告:
| 序号 | 实验 目的 | 实验内容 | 实验现象 | 实验结论 | 离子方程式 |
| 实验1 | ① | 在FeCl2溶液中滴入适量 氯水 | 溶液由浅绿色 变为黄色 | ② | ③ |
| 实验2 | ④ | 在FeCl2溶液中加入锌片 | / | ⑤ | Zn+Fe2+═Zn2++Fe |
| 实验3 | ⑥ | 在FeCl3溶液中加入足量 铁粉 | ⑦ | FeCl3(Fe3+)具有氧化性 | ⑧ |
| 实验4 | ⑨ | 在FeCl3溶液中滴入适量KI溶液和 淀粉溶液 | 淀粉溶液变蓝 | ⑩ | 2Fe3++2I-═2Fe2++I2 |
①验证Fe2+具有还原性③2Fe2++Cl2══2Fe3++2Cl- ⑤证明Fe2+具有氧化性⑧2Fe3++Fe══3Fe2+⑩证明Fe3+具有氧化性
综合以上实验,你能得到的结论是:⑪Fe3+有氧化性;Fe2+既有氧化性,又有还原性.
(2)除了以上性质,你认为FeCl2还可能具有的性质是:(用离子方程式表示,任写一个即可Fe2++2OH-=2Fe(OH)2↓.
(3)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液.保存亚铁盐溶液时如何防止亚铁盐被氧化加入少量铁粉.
(4)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可):加入KSCN溶液,无现象,再加入氯水(双氧水等合理氧化剂),溶液变血红色,或者加入K3[Fe(CN)6]产生蓝色沉淀.
(5)某同学向FeCl2中加入NaClO溶液,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是NaClO将Fe2+氧化为Fe3+,Fe3+转化为Fe(OH)3沉淀.
[样品]$→_{①}^{稀H_{2}SO_{4}边通N_{2}边煮沸}$[气体A]$→_{②}^{H_{2}O_{2}溶液}$[含H2SO4]$→_{③}^{NaOH溶液}$[中和液],下列说法不正确的是( )
| A. | 亚硫酸盐作为食品添加剂作用是防腐保鲜 | |
| B. | 反应①中通入N2的作用是将生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| ①中的物质 | ②中的物质 | 预测①的现象 | |
| A | 酚酞溶液 | 浓盐酸 | 无明显现象 |
| B | 淀粉KI溶液 | 浓硝酸 | 无明显现象 |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 加5 mL水,c (H+)增大 | B. | 加少量NaCl固体,c (H+)不变 | ||
| C. | 加少量碳酸钙粉末,c(HClO)升高 | D. | 加少量Na2SO3固体,溶液pH升高 |
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)白色沉淀是BaSO4.
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2.
①支持甲同学观点的实验证据是液面上方略显浅棕色.
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO+4H+.
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
| 实验操作 | 实验现象 |
向2mL0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 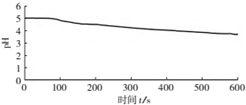 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 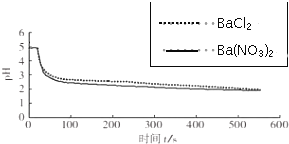 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(4)图2,BaCl2溶液中发生反应的离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+.
(5)依据上述图象你得出的结论是在氧化SO2的过程中,O2起了主要作用,说明理由在BaCl2溶液中起氧化作用的是O2,在Ba(NO3)2溶液中起氧化作用的是O2和NO3-,而图2中,分别向BaCl2、Ba(NO3)2溶液中通入SO2,pH变化趋势、幅度接近,因此起氧化作用的主要是O2.

