题目内容
9.亚硫酸盐是一种常见的食品添加剂.用如图实验可检验某食品中亚硫酸盐含量(含量通常以1kg样品中含SO2的质量计;所加试剂均足量).[样品]$→_{①}^{稀H_{2}SO_{4}边通N_{2}边煮沸}$[气体A]$→_{②}^{H_{2}O_{2}溶液}$[含H2SO4]$→_{③}^{NaOH溶液}$[中和液],下列说法不正确的是( )
| A. | 亚硫酸盐作为食品添加剂作用是防腐保鲜 | |
| B. | 反应①中通入N2的作用是将生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
分析 样品中加稀硫酸生成二氧化硫,通氮气将生成的二氧化硫从溶液中全部赶出,得到气体A为氮气和二氧化硫的混合气体,通入双氧水中,二氧化硫被氧化成硫酸,再用氢氧化钠中和得中和液含有硫酸钠,
A、亚硫酸盐有还原性,可以防止食品被空气中氧气氧化;
B、根据上面的分析可知,反应①中通入N2的作用是将生成的气体全部赶出;
C、根据③中耗碱量可以计算出生成的硫酸的物质的量,利用硫元素守恒可知二氧化硫的质量,结合样品的质量可求得样品中亚硫酸盐含量;
D、H2O2溶液替换为碘水,如果碘过量,碘与氢氧化钠反应,所以无法根据氢氧化钠的物质的量确定生成的硫酸的物质的量;
解答 解:样品中加稀硫酸生成二氧化硫,通氮气将生成的二氧化硫从溶液中全部赶出,得到气体A为氮气和二氧化硫的混合气体,通入双氧水中,二氧化硫被氧化成硫酸,再用氢氧化钠中和得中和液含有硫酸钠,
A、亚硫酸盐有还原性,可以防止食品被空气中氧气氧化,故A正确;
B、根据上面的分析可知,反应①中通入N2的作用是将生成的气体全部赶出,故B正确;
C、根据③中耗碱量可以计算出生成的硫酸的物质的量,利用硫元素守恒可知二氧化硫的质量,结合样品的质量可求得样品中亚硫酸盐含量,故C正确;
D、H2O2溶液替换为碘水,如果碘过量,碘与氢氧化钠反应,所以无法根据氢氧化钠的物质的量确定生成的硫酸的物质的量,故D错误;
故选D.
点评 本题目以工艺流程题的方式考查学生元素以及化合物的性质知识,注意原子守恒思想在解题中的应用,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
19.下列关于电解质的说法中正确的是( )
| A. | 强电解质在水中一定能全部溶解 | |
| B. | Cu能导电,因此Cu是电解质 | |
| C. | 弱电解质溶液的导电性可能比强电解质溶液的导电性强 | |
| D. | NaCl是电解质,故NaCl固体能导电 |
17.下列实验方法或操作能达到实验目的是( )
| A. | 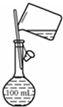 配制150mL 0.1 mol/L盐酸 | B. |  验证氨水呈碱性 | ||
| C. | 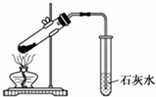 探究NaHCO3的热稳定性 | D. | 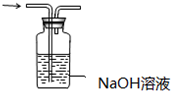 除去二氧化碳中的氯化氢 |
4.下列解释实验事实的方程式正确的是( )
| A. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| B. | 铜片溶于稀硝酸产生无色气体:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 氢氧化亚铁在空气中变质:2Fe(OH)2+O2+2H2O═2Fe(OH)3 | |
| D. | 碳酸钠溶液呈碱性:CO32-+2H2O?H2CO3+2OH- |
1.当光线通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 稀盐酸 | B. | CuSO4溶液 | C. | 酒精溶液 | D. | Fe(OH)3胶体 |
18.化学与日常生活紧密相关.下列说法中,不正确的是( )
| A. | 甲醛可作食品防腐剂 | B. | 氢氧化铝可作抗酸药 | ||
| C. | 氯化钠可作食品调味剂 | D. | 生石灰可作食品干燥剂 |
19.下列说法不正确的是( )
| A. | 室温下,在水中的溶解度:乙二醇>乙醇>苯酚 | |
| B. | 用质谱法可确定有机物分子中的官能团 | |
| C. | 用核磁共振氢谱能够区分CH3CH2CHO和CH3COCH3 | |
| D. | 乙二酸、甲醛、苯乙烯均可发生聚合反应 |
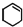 )为原料合成,路线如下(部分反应条件略):
)为原料合成,路线如下(部分反应条件略):



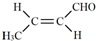 .
.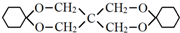 .
.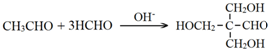 .
.