题目内容
5.下列反应的离子方程式书写正确的是( )| A. | Fe(NO3)3溶液中加入足量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 用H2O2和H2SO4的混合溶液蚀刻铜:Cu+H2O2+2H+═Cu2++2H2O | |
| C. | NH4HCO3溶液中加入足量澄清石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | C12通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O |
分析 A.酸性条件下硝酸根离子具有强氧化性,HI足量,硝酸根离子也参与反应;
B.双氧水具有强氧化性,能够将铜氧化成铜离子;
C.氢氧化钙足量,铵根离子和碳酸氢根离子都参与反应;
D.离子方程式两边负电荷不相等,违反了电荷守恒.
解答 解:A.硝酸铁稀溶液中加入足量稀氢碘酸,氢碘酸足量,铁离子、硝酸根离子都完全反应,正确的离子方程式为:10I-+3NO3-+Fe3++12H+═5I2+3NO↑+Fe2++6H2O,故A错误;
B.用H2O2和H2SO4的混合溶液蚀刻铜,反应的离子方程式为:Cu+H2O2+2H+═Cu2++2H2O,故B正确;
C.NH4HCO3溶液中加入足量澄清石灰水,铵根离子也参与反应,正确的反应为:Ca2++NH4++HCO3-+2OH-═CaCO3↓+H2O+NH3•H2O,故C错误;
D.C12通入NaOH溶液,反应生成氯化钠、次氯酸钠和水,正确的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
15.下列元素中,原子半径最大的是( )
| A. | Na | B. | Al | C. | P | D. | S |
16.下列离子方程式中,书写正确的是( )
| A. | 氢氧化镁溶于盐酸:OH-+H+═H2O | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Ag++Cu2+ | |
| C. | 将稀硫酸加入氢氧化钡溶液:H++OH-═H2O | |
| D. | 碳酸钠溶液与稀硫酸混合:CO32-+2H+═CO2↑+H2O |
13.NA表示阿伏伽德罗常数,则下列说法正确的是( )
| A. | 1 L 0.1 mol/LNaHSO4溶液中含有0.1 NA个HSO4- | |
| B. | 已知反应:5Cl-+ClO3-+6H+=3Cl2+3H2O,每生成71g Cl2,则转移2NA个电子 | |
| C. | 乙烯(C2H4)和环丙烷(C3H6)组成的28g混合气体中含有氢原子数为4NA个 | |
| D. | 标准状况下,22.4LCCl4中含有NA个CCl4分子 |
20.工业上通过2Al2O3+3C+6Cl2$\frac{\underline{\;高温\;}}{\;}$4AlCl3+3CO2制取无水氯化铝,下列说法正确的是( )
| A. | AlCl3是氧化产物 | B. | 每生成1molCO2,转移2mol电子 | ||
| C. | Cl2是氧化剂 | D. | C发生还原反应 |

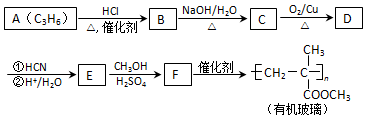
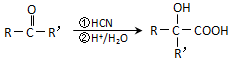 (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子)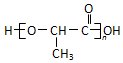 )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线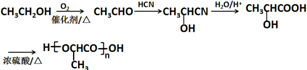 .(示例:反应条件X$\stackrel{反应条件1}{→}$Y$\stackrel{反应条件2}{→}$Z …)
.(示例:反应条件X$\stackrel{反应条件1}{→}$Y$\stackrel{反应条件2}{→}$Z …)