题目内容
2.下列五种物质中,用序号填写①Ar ②CO2 ③H2SO4④K2S⑤NaOH只存在共价键的是②③,只存在离子键的是④,既存在离子键又存在共价键的是⑤,不存在化学键的是①.属于共价化合物的是②③,属于离子化合物的是④⑤.
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,单原子分子中不存在化学键,据此分析解答.
解答 解:①Ar为单原子分子,不存在化学键;
②CO2中C-O原子之间只存在共价键,属于共价化合物;
③H2SO4中原子之间只存在共价键,属于共价化合物;
④K2S中钾离子和硫离子之间只存在离子键,
⑤NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键;
通过以上分析知只存在共价键的是②③,只存在离子键的是④,存在离子键和共价键的是⑤,不存在化学键的是①,属于共价化合物的是 ②③,属于离子化合物的是④⑤,故答案为:②③;④;⑤;①;②③,④⑤.
点评 本题考查化学键,侧重考查基本概念,明确物质构成微粒及微粒之间作用力即可解答,注意并不是所有物质中都含有化学键,稀有气体不含化学键,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,进行了如下实验:
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理:2KMnO4+5H2C2O4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O.
(2)根据表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度,反应速率增大.
(3)利用实验3中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=1.5×10-2mol/(L•min).
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.

该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | ||
| 1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理:2KMnO4+5H2C2O4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O.
(2)根据表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度,反应速率增大.
(3)利用实验3中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=1.5×10-2mol/(L•min).
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.

该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
13.下列说法正确的是( )
| A. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| B. | 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu | |
| C. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H>0,△S<0 | |
| D. | 将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深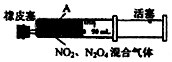 |
10.下列说法中错误的是( )
| A. | 卤化氢中,以HF沸点最高,是由于HF分子间存在氢键 | |
| B. | 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 | |
| C. | H2O的沸点比HF的沸点高,是由于水中氢键键能大 | |
| D. | 氨气极易溶于水与氨气分子和水分子形成氢键有关 |
17.下列各项表述正确的是( )
| A. | 丙烯的键线式: | B. | CH2F2的电子式: | ||
| C. | 醛基官能团符号:-COH | D. | -OH与 都表示羟基 都表示羟基 |
7.下列各组物质性质的比较中正确的是( )
| A. | 酸性:H3PO4>H2SO4>HClO4 | B. | 碱性:Mg(OH)2>Ca(OH)2>KOH | ||
| C. | 热稳定性:H2S>H2O>HF | D. | 氧化性:F2>Cl2>Br2>I2 |
14.T1和T2温度下(T1>T2),BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
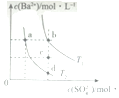

| A. | T1时,c点有沉淀生成 | |
| B. | T2时,蒸发溶剂可能由d点变到b点 | |
| C. | T2时,由a点开始加入BaCl2固体,Ksp增大 | |
| D. | BaSO4的溶解度随温度升高而增大 |
11.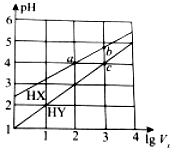 25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )
25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )
 25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )
25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )| A. | HX为弱酸,HY为强酸 | B. | 当lgV0=7时,HY的pH=8 | ||
| C. | 溶液中水的电离程度:a=c<b | D. | 当lgV0=2时,c(X-)<c(Y-) |
12.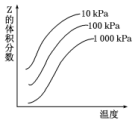 如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
 如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )| A. | 恒容时,混合气体的密度可作为此反应是否达到化学平衡状态的判断依据 | |
| B. | X、Y、Z均为气态 | |
| C. | 上述反应的逆反应的△H>0 | |
| D. | 使用催化剂Z的产率提高 |