题目内容
13.下列说法正确的是( )| A. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| B. | 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu | |
| C. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H>0,△S<0 | |
| D. | 将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深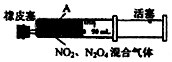 |
分析 A.氨水存在电离平衡NH3•H2O?NH4++OH-,向氨水中不断通入CO2,CO2呈酸性,使平衡向正反应方向进行,故c(OH-)增加,c(NH3•H2O)减小,则$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增加;
B.在铜的电解精炼过程中,若转移1mol电子,则阳极溶解的不仅仅是铜,还有铁锌等金属,故铜的质量小于32gCu;
C.该反应能自发进行,且△S<0,应满足△H-T•△S<0,以此进行判断;
D.左侧压缩体积变小,二氧化氮的浓度变大气体颜色先变深,后平衡正向移动颜色逐渐变浅.
解答 解:A.氨水存在电离平衡NH3•H2O?NH4++OH-,向氨水中不断通入CO2,CO2呈酸性,使平衡向正反应方向进行,故c(OH-)增加,c(NH3•H2O)减小,则$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增加,故A错误;
B.在铜的电解精炼过程中,若转移1mol电子,则阳极溶解的不仅仅是铜,还有铁锌等金属,故铜的质量小于32gCu,故B错误;
C.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,应满足△H-T•△S<0,该反应为熵减反应,即△S<0,说明是放热反应,△H<0,故C错误;
D.左侧压缩体积变小,二氧化氮的浓度变大气体颜色先变深,后平衡正向移动颜色逐渐变浅,平衡移动的结果是减弱而不是抵消,所以颜色比原来深,故D正确;
故选D.
点评 本题考查了平衡移动、电解原理、能够根据焓变和熵变判断反应能否自发进行,以及压强对化学平衡的影响,难度不大,可根据勒夏特里原理来分析解答即可.

练习册系列答案
相关题目
4. 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.
(1)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
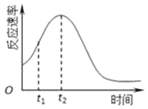
(2)双鸭山市第一中学高二化学兴趣小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①此反应放热,温度升高,化学反应速率加快;②生成物中的锰离子(或硫酸锰)为此反应的催化剂.
(3)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=3,C=100,E=20
(4)若t1<t2,则根据实验①和②得到的结论是其他条件相同时,溶液的初始pH越小,该反应的反应速率越快.
 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.(1)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(2)双鸭山市第一中学高二化学兴趣小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①此反应放热,温度升高,化学反应速率加快;②生成物中的锰离子(或硫酸锰)为此反应的催化剂.
(3)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=3,C=100,E=20
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 40 | 100 | 60 | t1 |
| ② | 常温 | A | B | C | 60 | t2 |
| ③ | 常温 | 3 | 80 | D | E | t3 |
1.氯气是一种重要的工业原料.工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1 mol N2有3 mol 电子转移 | D. | 该反应不属于复分解反应 |
8.化学与生活密切相关,下列有关说法错误的是( )
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本 |
18.X、Y、Z、W四种短周期元素的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族,下列叙述正确的是( )
| A. | X只能形成一种氧化物 | |
| B. | 化合物YX比WX3的熔点高 | |
| C. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| D. | 原子半径的大小顺序:r(X)<r(Y)<r(Z)<r(W) |
5.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素叙述正确的是( )
| A. | 气态氢化物的稳定性:D>C | B. | 四种元素一定属于短周期元素 | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
3.反应N2+3H2?2NH3,在2L的密闭容器内进行到半分钟时,有0.6mol NH3生成,则下列反应速率不正确的是( )
| A. | ${V}_{N{H}_{3}}$=0.6mol/L•min | B. | ${V}_{{N}_{2}}$=0.005mol/L•s | ||
| C. | ${V}_{{H}_{2}}$=0.9mol/L•min | D. | ${V}_{N{H}_{3}}$=0.02mol/L•s |