题目内容
11.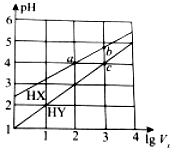 25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )
25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )| A. | HX为弱酸,HY为强酸 | B. | 当lgV0=7时,HY的pH=8 | ||
| C. | 溶液中水的电离程度:a=c<b | D. | 当lgV0=2时,c(X-)<c(Y-) |
分析 A.由图象可知0.1mol•L-1的HYpH=1,为强酸,HX的pH>2,说明没有完全电离;
B.稀释酸溶液,pH不可能大于7;
C.酸溶液中氢离子浓度越大,水的电离程度越低;
D.HY酸性比HX弱,不能完全电离.
解答 解:A.由图象可知0.1mol•L-1的HYpH=1,为强酸,HX的pH>2,说明为弱酸,故A正确;
B.稀释酸溶液,pH不可能大于7,不可能为8,故B错误;
C.酸溶液中氢离子浓度越大,水的电离程度越低,图象中a、c pH相同,水的电离程度相等,b的氢离子浓度较小,对水的抑制较小,则水的电离程度较大,故C正确;
D.HY酸性比HX弱,不能完全电离,则当lgV0=2时,c(X-)<c(Y-),故D正确.
故选B.
点评 本题考查弱电解质电离,为高频考点,侧重考查学生分析推断及识图能力,正确判断两种酸的强弱是解本题关键,注意把握图象的分析,把握弱电解质的电离特点,难度不大.

练习册系列答案
相关题目
1.氯气是一种重要的工业原料.工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1 mol N2有3 mol 电子转移 | D. | 该反应不属于复分解反应 |
19.化学在古代与现代的科技发展中起了十分重要的作用,下列说法中正确的是( )
 |  |  |  |
| 古代与现代的冶金均运用了相同的化学原理 | 古代与现代的火箭发射均利用了液体燃料 | 古代捣碎中药与现代中药纳米粉碎均是化学变化 | 古代风筝与现代热气球飞行均无需物质直接供给能量 |
| A. | A | B. | B | C. | C | D. | D |
6.下列实验操作对应的现象、结论均正确的是( )
| 操作 | 现象 | 结论 | |
| A | 将含酚酞的Na2CO3溶液与BaCl2溶液混合 | 红色变浅 | Na2CO3溶液中存在水解平衡 |
| B | 将Cl2通入I2淀粉溶液中 | 溶液蓝色褪去 | Cl2有漂白性 |
| C | 向含等浓度的NaCl和KI溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 试管中加入少量淀粉和稀硫酸,冷却后加入NaOH溶液中和至碱性,再加入碘水 | 溶液未变蓝 | 淀粉己完全水解 |
| A. | A | B. | B | C. | C | D. | D |
16.下列关于有机化合物的说法正确的是( )
| A. | 乙醇能发生取代反应和加成反应 | |
| B. | 1mol 3-(2-噻吩)丙烯酸(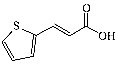 )发生加成反应时最多消耗3mol H2 )发生加成反应时最多消耗3mol H2 | |
| C. | 淀粉和纤维素的分子通式均为(C6H10O5)n,故淀粉和纤维素互为同分异构体 | |
| D. | 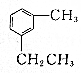 与 与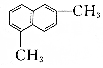 都属于芳香烃,二者互为同系物 都属于芳香烃,二者互为同系物 |
3.反应N2+3H2?2NH3,在2L的密闭容器内进行到半分钟时,有0.6mol NH3生成,则下列反应速率不正确的是( )
| A. | ${V}_{N{H}_{3}}$=0.6mol/L•min | B. | ${V}_{{N}_{2}}$=0.005mol/L•s | ||
| C. | ${V}_{{H}_{2}}$=0.9mol/L•min | D. | ${V}_{N{H}_{3}}$=0.02mol/L•s |
20.不锈钢是由铁、铬、镍,碳及众多不同元素所组成的合金,铁是主要成分元素,铬是笫一主要的合金元素.其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀.

(1)基态碳(C)原子的电甲排布图为 .
.
(2)[Cr(H20)4Cl2]•2H2O 中Cr的配位数为6.
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子价层电子排布式为3d54s1.
(4)Fe的一种晶胞结构如甲、乙所示,若按甲中虚线方向切乙得到的A〜D图中正确的是A.
(5)据报道,只含镁、镍和碳三种元素的晶体具 有超导性.鉴于这三种元素都是常见元素,从而引起广泛关注.该晶体的晶胞结构如下图所示,晶体中每个镁原子周围距离最近的镍原子有12个,试写出该晶体的化学式MgCNi3.
(6)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1),回答下列问题.
①在周期表中,最可能处于同一族的是R和U.
②T元素最可能是P区元素.若T为第二周期元素,F.是第三周期元素中原子半径最小的元素,则T、F形成的化合物的空间构型为平面三角形,其中心原子的杂化方式为sp2.

(1)基态碳(C)原子的电甲排布图为
 .
.(2)[Cr(H20)4Cl2]•2H2O 中Cr的配位数为6.
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子价层电子排布式为3d54s1.
(4)Fe的一种晶胞结构如甲、乙所示,若按甲中虚线方向切乙得到的A〜D图中正确的是A.
(5)据报道,只含镁、镍和碳三种元素的晶体具 有超导性.鉴于这三种元素都是常见元素,从而引起广泛关注.该晶体的晶胞结构如下图所示,晶体中每个镁原子周围距离最近的镍原子有12个,试写出该晶体的化学式MgCNi3.
(6)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1),回答下列问题.
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2 080 | 4 000 | 6 100 | 9 400 |
| R | 500 | 4 600 | 6 900 | 9 500 |
| S | 740 | 1 500 | 7 700 | 10 500 |
| T | 580 | 1 800 | 2 700 | 11 600 |
| U | 420 | 3 100 | 4 400 | 5 900 |
②T元素最可能是P区元素.若T为第二周期元素,F.是第三周期元素中原子半径最小的元素,则T、F形成的化合物的空间构型为平面三角形,其中心原子的杂化方式为sp2.
2. 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法(写一种):测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表.
(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
(4)该实验进行的目的是探究反应物浓度(Na2S2O3)对化学反应速率的影响;,表中Vx=4 mL,比较t1、t2、t3大小,试推测该实验结论:t1<t2<t3.
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法(写一种):测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表.
(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |