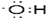��Ŀ����
9�� �ö������ȣ�ClO2�����������ƣ�Na2FeO4�������;�ˮ�������ͳ�ľ�ˮ��Cl2�Ե�ˮ���������dz�������ˮ�����¼�����ClO2��Na2FeO4��ˮ���������зֱ𱻻�ԭΪCl-��Fe3+��
�ö������ȣ�ClO2�����������ƣ�Na2FeO4�������;�ˮ�������ͳ�ľ�ˮ��Cl2�Ե�ˮ���������dz�������ˮ�����¼�����ClO2��Na2FeO4��ˮ���������зֱ𱻻�ԭΪCl-��Fe3+����1������Ե�λ���������������õ��ĵ���������ʾ����Ч�ʣ���ôClO2��Na2FeO4��Cl2��������ɱ����������Ч���ɴ�С��˳����ClO2��Cl2��Na2FeO4�����ѧʽ��
��2������������һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ-59�棬�е�Ϊ11.0�棬������ˮ����ҵ�����Գ�ʪ��KClO3�Ͳ��ᣨH2C2O4����60��ʱ��Ӧ�Ƶã�ijѧ��������ͼ��ʾ��װ��ģ�ҵ��ȡ���ռ�ClO2������AΪClO2�ķ���װ�ã�BΪClO2������װ�ã�CΪβ������װ�ã� ��ش��������⣺
��A�з�Ӧ������K2CO3��ClO2��CO2�ȣ���д���÷�Ӧ�Ļ�ѧ����ʽ��2KClO3+H2C2O4=K2CO3+2ClO2��+CO2��+H2O��
A���ֻ�Ӧ������ˮԡ����60����¶ȣ�B���ֻ�Ӧ����ʲôװ�ã���ˮԡ����װ�û�ʢ�б�ˮ��ˮ�ۣ�
�ڸ�װ�ð��ٲ���������װ��A��B��C�л���һ��������Բ���������C���A��B��C����
��C�е��Լ�ΪNaOH��Һ����Ӧʱ���������ƺ��������ƣ�NaClO2�����÷�Ӧ�����ӷ���ʽΪ2ClO2+2OH-�TClO3-+ClO2-+H2O����ʵ��ʱ��Ҫ450mL 4mol/L��NaOH��Һ�����ھ�ȷ����ʱ����Ҫ��ȡNaOH��������80.0g����ʹ�õ�������������ƽ����Ͳ����ͷ�ιܡ��������⣬��������500mL����ƿ���ձ���
���� ��1���Ե�λ���������������õ��ĵ���������ʾ����Ч�ʣ���������Ϊm������Ч�ʷֱ�Ϊ$\frac{m}{67.5}$��5��$\frac{m}{166}$��3��$\frac{m}{71}$��2��1��
��2����A�з�Ӧ������K2CO3��ClO2��CO2����Ϸ�Ӧ������������д��Ӧ����ʽ������BΪClO2������װ�ý�϶���������һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ-59�棬�е�Ϊ11.0���жϣ�
��C��Ϊ�ܷ�װ�ã��������岻���ų���
��ClO2��NaOH��Ӧ��Ӧʱ���������ƺ��������ƣ�NaClO2��������450mL 4mol/L��NaOH��Һ��Ӧѡ��500mL����ƿ�����m=cVM���㣮
��� �⣺��1���Ե�λ���������������õ��ĵ���������ʾ����Ч�ʣ���������Ϊm������Ч�ʷֱ�Ϊ$\frac{m}{67.5}$��5��$\frac{m}{166}$��3��$\frac{m}{71}$��2��1�������ɴ�С��˳��ΪClO2��Cl2��Na2FeO4���ʴ�Ϊ��ClO2��Cl2��Na2FeO4��
��2����A�з�Ӧ������K2CO3��ClO2��CO2���ɷ�Ӧ�����������֪��ӦΪ2KClO3+H2C2O4=K2CO3+2ClO2��+CO2��+H2O����ΪBΪClO2������װ�ã��ֶ���������һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ-59�棬�е�Ϊ11.0�棬����B���ֻ�Ӧ����װ��Ϊ��ˮԡ����װ�û�ʢ�б�ˮ��ˮ�ۣ�
�ʴ�Ϊ��2KClO3+H2C2O4=K2CO3+2ClO2��+CO2��+H2O����ˮԡ����װ�û�ʢ�б�ˮ��ˮ�ۣ�
��C��Ϊ�ܷ�װ�ã��������岻���ų����ɵ�������ը�ѣ���C���������ʴ�Ϊ��C��
��CΪβ������װ�ã���ѡ��NaOH��Һ������β��������������ԭ��ӦΪ2ClO2+2NaOH�TNaClO2+NaClO3+H2O�����ӷ�ӦΪ2ClO2+2OH-=ClO2-+ClO3-+H2O������450mL 4mol/L��NaOH��Һ������Ҫ500mL����ƿ���ձ�����ҪNaOH������Ϊ0.5L��4mol/L��40g/mol=80.0g��
�ʴ�Ϊ��2ClO2+2OH-=ClO2-+ClO3-+H2O��80.0��500mL����ƿ���ձ���
���� �������ȼ��仯��������ʿ���������ԭ��Ӧ�����ʵ��Ʊ�ʵ�飬����ϰ���е���Ϣ��֪ʶǨ��Ӧ��Ϊ���Ĺؼ�������ѧ���ۺ�Ӧ����������Ϣ��ȡ�ͷ��������Ŀ��飬��Ŀ�Ѷ��еȣ�

 ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�| A�� | $\frac{1}{2}$N2H4+$\frac{1}{2}$O2�T$\frac{1}{2}$N2+H2O��H=-267 kJ•mol-1 | |
| B�� | N2H4��g��+O2��g���TN2��g��+2H2O��l����H=-133.5 kJ•mol-1 | |
| C�� | N2H4��g��+O2��g���TN2��g��+2H2O��g����H=+534 kJ | |
| D�� | N2H4��g��+O2��g���TN2��g��+2H2O��g����H=-534 kJ•mol-1 |
| A�� | ���κ������£���ѧƽ�ⳣ������һ����ֵ | |
| B�� | ��ѧƽ�ⳣ��K�����ƶ�һ�����淴Ӧ���еij̶� | |
| C�� | ��ѧƽ�ⳣ��Kֻ���¶ȡ���Ӧ��Ũ�ȡ���ϵ��ѹǿ�й� | |
| D�� | ���ı䷴Ӧ���Ũ��ʱ����ѧƽ�ⳣ���ᷢ���ı� |
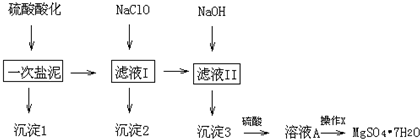
���������������������PH
| ���� | ��ʼ���� | ��ȫ���� |
| Fe��OH��3 | 2.7 | 3.7 |
| Fe��OH��2 | 7.6 | 9.6 |
| Mn��OH��2 | 8.3 | 9.8 |
| Mg��OH��2 | 9.6 | 11.1 |
| Al��OH��3 | 3.7 | 5.7 |
| ��ʼ�ܽ⣺7.8 | ��ȫ�ܽ⣺10.0 |
��1����H2SO4������ҺPH��1��2��H2SO4�����ǽ������е�̼���κ�����ת��Ϊ�����Ե������Σ�ͬʱ��������ƺ����ȥ
��2����NaClO��Һ��PH=5��6���������5��10���ӣ�����2����Ҫ����MnO2���������������������������Ļ�ѧʽ�ֱ�ΪFe��OH��3��Al��OH��3������NaClO��Һ��MnSO4ת��ΪMnO2�����ӷ���ʽΪClO-+Mn2++H2O=MnO2+Cl-+2H+
��3��������Һ�����Ƿ���Fe3+��ʵ�鷽����ȡ��Һ��1-2ml���Թ��У�����������KSCN��Һ���������ɫ��֤����Һ������Fe3+
��4��������X���ǽ���Һ����Ũ���������ᾧ������ϴ�ӣ����õ�MgSO4•7H2O���壮
��5�������ҺA�ܷ�õ�����Mg���ܣ���ܡ����ܡ�����������ӦʽΪ2H2O-4e-=O2��+4H+
��6��ȷ�����Ƶõ���Ʒ5g����200mLˮ�ܽ⣬����2mol•L-1������5mL���ڲ��Ͻ����µμ�����2mol•L-1 BaCl2��Һ����ַ�Ӧ�ó���4.46g������Ʒ����Ϊ98.4%��
| A�� | 4molNH3��5molO2��Ӧ���ﵽƽ��ʱ�ų�����Ϊ905.9kJ | |
| B�� | ƽ��ʱv����O2��=v����NO�� | |
| C�� | ƽ���ѹǿ���������ƽ��Ħ���������� | |
| D�� | ƽ��������¶ȣ����������NO�������� |
| A�� | KMnO4=K++Mn7++4O2- | B�� | Ba��OH��2�TBa2++��OH-��2 | ||
| C�� | Mg��NO3��2=Mg+2+2NO3- | D�� | NaHCO3�TNa++HCO3- |
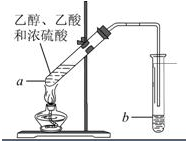 �����Ѿ��ܷⴢ��ʱ��Խ��������Խ�ã�ԭ��֮һ�Ǵ������������������ζ��������ʵ����Ҳ��������ͼ��ʾ��װ����ȡ������������ش��������⣮
�����Ѿ��ܷⴢ��ʱ��Խ��������Խ�ã�ԭ��֮һ�Ǵ������������������ζ��������ʵ����Ҳ��������ͼ��ʾ��װ����ȡ������������ش��������⣮