题目内容
2.把0.2molX气体和0.5molY气体混合于1L密闭容器中,使它们发生如下反应:2X(g)+3Y(g)=nZ(g)+4W(g).2min末已生成0.2molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L•min),试计算:(1)前2min内用W的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
分析 2min末已生成0.2molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L•min),可知生成n(Z)=0.05mol/(L•min)×1L×2min=0.1mol,n=2,则
2X(g)+3Y(g)=2Z(g)+4W(g)
起始(mol) 0.2 0.5 0 0
转化(mol) 0.1 0.15 0.1 0.2
平衡(mol) 0.1 0.35 0.1 0.2,
以此解答该题.
解答 解:2min末已生成0.2molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L•min),可知生成n(Z)=0.05mol/(L•min)×1L×2min=0.1mol,n=2,则
2X(g)+3Y(g)=2Z(g)+4W(g)
起始(mol) 0.2 0.5 0 0
转化(mol) 0.1 0.15 0.1 0.2
平衡(mol) 0.1 0.35 0.1 0.2,
(1)2min末已生成0.2molW,则v(W)=$\frac{\frac{0.2mol}{1L}}{2min}$=0.1mol/(L•min),
答:前2min内用W的浓度变化表示的平均反应速率为0.1mol/(L•min);
(2)2min末时Y的浓度$\frac{0.35mol}{1L}$=0.35mol/L,
答:2min末时Y的浓度为0.35mol/L;
(3)由以上分析可知n=2,
答:n=2.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学反应速率、物质的量浓度的计算及化学反应速率与化学计量数的关系,明确化学反应速率的概念及表达式为解答关键,试题培养了学生的分析能力及化学计算能力.

| A. | 混合物 | B. | 单质 | C. | 氧化物 | D. | 化合物 |

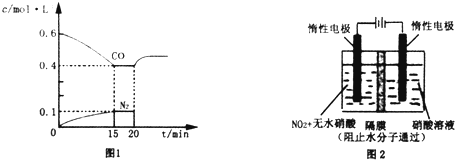
 在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数
在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数 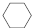 (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$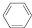 (g)+3H2(g).
(g)+3H2(g).
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.