题目内容
5.下列关于化学平衡常数的说法中,正确的是( )| A. | 在任何条件下,化学平衡常数都是一个定值 | |
| B. | 化学平衡常数K可以推断一个可逆反应进行的程度 | |
| C. | 化学平衡常数K只与温度、反应物浓度、体系的压强有关 | |
| D. | 当改变反应物的浓度时,化学平衡常数会发生改变 |
分析 K为生成物浓度幂之积与反应物浓度幂之积的比,可衡量反应正向进行的趋势,K越大,转化率越大,且K只与温度有关,以此来解答.
解答 解:A.K与温度有关,温度不同时化学平衡常数不同,故A错误;
B.化学平衡常数K可以推断一个可逆反应进行的程度,K越大,正向进行的趋势越大,故B正确;
C.化学平衡常数K只与温度有关,与反应物浓度、体系的压强无关,故C错误;
D.当改变反应物的浓度时,化学平衡常数不变,故D错误;
故选B.
点评 本题考查化学平衡常数的意义,为高频考点,把握平衡常数K的意义、K的影响因素为解答的关键,侧重分析与应用能力的考查,注意K只与温度有关,题目难度不大.

练习册系列答案
相关题目
18.废电池的污染引起人们的广泛关注,废电池对环境污染的主要物质是( )
| A. | 石墨 | B. | 二氧化锰 | C. | 锌 | D. | 汞 |
13.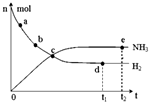 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g).在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g).在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g).在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g).在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到化学平衡状态 | |
| C. | 点d和点e处的n(N2)不相同 | |
| D. | 点e反应达到化学平衡状态,反应停止 |
14.将 AgNO3、Ba(NO3)2、Na2SO4、NaCl 四种电解质按物质的量之比1:1:1:2加入足量蒸馏水中,然后用铂电极电解该混合物至不再有溶质离子参与反应时,则所得氧化产物与还原产物的质量比为( )
| A. | 71:2 | B. | 35.5:108 | C. | 108:35.5 | D. | 71:109 |
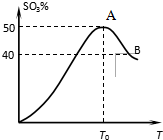 在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数
在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数 
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.