题目内容
19.下列实验操作、现象与实验结论一致的是( )| 选项 | 实验操作及现象 | 实验结论 |
| A | SO2通入Ba(NO3)2溶液中,有白色沉淀生成 | 发生复分解反应生成难溶物质BaSO3 |
| B | 某溶液滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中可能不含SO42- |
| C | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别 滴加CCl4,振荡,静置,下层分别呈无色和紫红色 | 氧化性:Fe3+>Br2>I2 |
| D | 向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴 加1~2滴0.01mol•L-1 AgNO3溶液,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.SO2通入Ba(NO3)2溶液中,发生氧化还原反应生成硫酸钡沉淀;
B.生成的白色沉淀可能为氯化银,不一定为硫酸钡;
C.铁离子的氧化性小于溴单质;
D.溶度积越小,难溶物的溶解度越小.
解答 解:A.SO2通入Ba(NO3)2溶液中,发生氧化还原反应生成硫酸钡沉淀,BaSO3溶于硝酸发生氧化还原反应,结论不合理,故A错误;
B.某溶液滴加盐酸酸化的BaCl2溶液,生成白色沉淀,该沉淀可能为AgCl,原溶液中可能含有氯离子,不一定含有SO42-,该实验操作、现象与实验结论一致,故B正确;
C.将FeCl3溶液分别滴入NaBr,滴加CCl4,振荡,静置,下层呈无色,说明溴离子没有被氧化,则氧化性:Fe3+<Br2,该结论不合理,故C错误;
D.向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1 AgNO3溶液,沉淀呈黄色,说明优先生成碘化银沉淀,则碘化银的溶度积较小,即:Ksp(AgCl)>Ksp(AgI),该结论不合理,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及难溶物溶解平衡、氧化还原反应、常见离子的检验方法等知识,把握物质的性质、反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,选项A为易错点,题目难度不大.

练习册系列答案
相关题目
10.氨既是重要工业产品又是化工原料,由氨可以制备一系列物质(见图),下列说法正确的是( )


| A. | 图中所述反应都发球氧化还原反应 | |
| B. | CO(NH2)2与氰酸铵(NH4CNO)互为同素异形体 | |
| C. | Si3N4属于离子化合物 | |
| D. | NH3与NaClO反应,N2N4是氧化产物 |
7.胶体是一种微粒直径在1-100nm之间的分散系.下列事实与胶体的性质无关的是( )
| A. | 清晨在密林中看到一缕缕光束 | |
| B. | 盐酸与硝酸银溶液反应生成白色沉淀 | |
| C. | 豆浆中加入盐卤做豆腐 | |
| D. | 一束平行光射入蛋白质溶液中,侧面可看到一束光亮的通路 |
14.在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8溶液会发生如下离子反应(未配平):Mn2++S2O82一+H2O→MnO4一+SO42一+H+,下列说法不正确的是( )
| A. | 氧化性比较:S2O82 ->MnO4- | |
| B. | 氧化剂S2O82-的摩尔质量为 192 g/mol | |
| C. | 该反应中酸性介质可以为盐酸 | |
| D. | 若有0.1 mol氧化产物生成,则转移电子 0.5 mol |
6.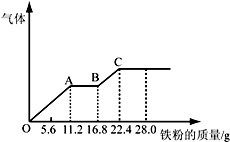 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 混合酸中NO3-物质的量为0.2mol | |
| B. | OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 | |
| C. | 第二份溶液中最终溶质为FeSO4 | |
| D. | H2SO4浓度为4mol•L-1 |
7.萜品醇可作为消毒剂、抗氧化剂和溶剂.已知α-萜品醇的结构简式如式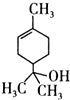 ,则下列说法错误的是( )
,则下列说法错误的是( )
 ,则下列说法错误的是( )
,则下列说法错误的是( )| A. | 1mol该物质最多能和lmol氢气发生加成反应 | |
| B. | 该物质属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C10H18O |
