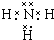题目内容
4.下表是周期表中的一部分
根据表中各元素回答下列问题:
(1)非金属性最强的元素是F(填元素符号,下同),形成化合物种类最多的元素是C.
(2)最高价氧化物的水化物酸性最强的是HClO4(填化学式,下同),呈两性的是Al(OH)3.
(3)②的气态氢化物与⑧的最高价氧化物的水化物按2:1比例相互反应的化学方程式2NH3+H2SO4=(NH4)2SO4.
(4)⑧的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,请写出反应的化学方程式S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
(5)利用非金属与盐溶液的置换反应比较③与⑧的氧化性强弱,可采用的方法是将O2通入Na2S溶液中,预期出现的现象是溶液中出现淡黄色浑浊.
(6)②的多种氧化物中,甲为红棕色气体.标准状况下,6.72L的甲气体与足量水完全反应后得到500mL溶液,所生成溶液中溶质的物质的量浓度为0.4mol/L.
分析 由元素在周期表中的位置可知,①为C,②为N,③为O,④为F,⑤为Na,⑥为Mg,⑦为Al,⑧为S,⑨为Cl,⑩为Ar,
(1)F的非金属性最强,C形成有机物种类最多;
(2)高氯酸为所有含氧酸中酸性最强的酸,氢氧化铝具有两性;
(3)氨气与硫酸反应生成硫酸铵;
(4)S与浓硫酸反应生成二氧化硫和水;
(5)单质之间的置换反应可比较非金属性;
(6)甲为红棕色气体,甲为NO2,发生3NO2+H2O=2HNO3+NO,结合n=$\frac{V}{Vm}$、c=$\frac{n}{V}$计算.
解答 解:由元素在周期表中的位置可知,①为C,②为N,③为O,④为F,⑤为Na,⑥为Mg,⑦为Al,⑧为S,⑨为Cl,⑩为Ar,
(1)以上元素中第二周期中F的非金属性最强,在第ⅦA中F的非金属性最强,则F的非金属性最强,碳元素形成的有机物种类最多,故答案为:F;C;
(2)最高价氧化物的水化物酸性最强的是HClO4,Al元素的最高价氧化物对应水化物Al(OH)3的具有两性,
故答案为:HClO4;Al(OH)3;
(3)②的气态氢化物与⑧的最高价氧化物的水化物按2:1比例相互反应的化学方程式为2NH3+H2SO4=(NH4)2SO4,
故答案为:2NH3+H2SO4=(NH4)2SO4;
(4)⑧的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O,
故答案为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O;
(5)比较③与⑧的氧化性强弱,可采用的方法是将O2通入Na2S溶液中,现象为溶液中出现淡黄色浑浊,
故答案为:将O2通入Na2S溶液中;溶液中出现淡黄色浑浊;
(6)甲为红棕色气体,甲为NO2,其物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,由3NO2+H2O=2HNO3+NO可知生成硝酸的物质的量为0.2mol,则反应后得到500mL溶液,所生成溶液中溶质的物质的量浓度为$\frac{0.2mol}{0.5L}$=0.4mol/L,故答案为:0.4mol/L.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析和应用能力的考查,注意元素化合物知识、元素周期律的应用,综合性较强,题目难度不大.

 快捷英语周周练系列答案
快捷英语周周练系列答案| A. | 常温常压下,18g重水(D2O)中所含的电子数为10 NA | |
| B. | 标准状况下,14g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4L氢气和氯气的混合气体中含有的分子总数为NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移电子数为NA |
实验一:取第一块铝片,直接放入硫酸铜溶液中观察现象
实验二:取第二块铝片,用砂纸擦试表面后,放入硫酸铜溶液中观察现象
实验三:将实验一中铝片从硫酸铜溶液中取出,洗净后放入氢氧化钠溶液中,片刻后取出铝片,洗净后再放入硫酸铜溶液中观察现象
实验四:取第三块铝片,用砂纸擦试表面后,置于浓硝酸中,片刻后取出,洗净,再放入硫酸铜溶液中观察现象
综合以上四个实验的主要目的是试图说明( )
| A. | 铝片能和硫酸铜溶液反应 | |
| B. | 铝片能和氢氧化钠溶液反应 | |
| C. | 铝片不能和硝酸反应 | |
| D. | 铝片表面能形成具有保护作用的氧化膜 |
| A. | 甲烷中混有少量乙烯,可将混合气体通入盛有酸性高锰酸钾溶液的洗气瓶中除去 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色 | |
| C. | 在苯中加入溴的四氯化碳溶液,振荡并静置后下层液体为无色 | |
| D. | 食物中含有大量的纤维素,可以在人体内直接水解成葡萄糖成为营养物质 |
| 选项 | 实验操作及现象 | 实验结论 |
| A | SO2通入Ba(NO3)2溶液中,有白色沉淀生成 | 发生复分解反应生成难溶物质BaSO3 |
| B | 某溶液滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中可能不含SO42- |
| C | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别 滴加CCl4,振荡,静置,下层分别呈无色和紫红色 | 氧化性:Fe3+>Br2>I2 |
| D | 向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴 加1~2滴0.01mol•L-1 AgNO3溶液,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
| A. | NaOH+KCl=NaCl+KOH | B. | AgNO3+NaCl=AgCl↓+NaNO3 | ||
| C. | Na2CO3+Ca(OH)2=CaCO3↓+2NaOH | D. | NaOH+NH4NO3=NaNO3+NH3•H2O |
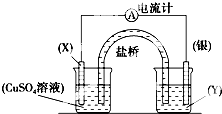 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: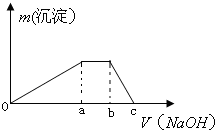 甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验:
甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验: