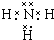题目内容
7.萜品醇可作为消毒剂、抗氧化剂和溶剂.已知α-萜品醇的结构简式如式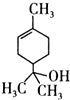 ,则下列说法错误的是( )
,则下列说法错误的是( )| A. | 1mol该物质最多能和lmol氢气发生加成反应 | |
| B. | 该物质属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C10H18O |
分析 该分子中含有醇羟基、碳碳双键,具有醇和烯烃性质,能发生取代反应、氧化反应、加成反应、还原反应、加聚反应、酯化反应等,以此解答该题.
解答 解:A.含有一个碳碳双键,所以1mol该物质最多能和lmol氢气发生加成反应,故A正确;
B.该分子中除了含有C、H元素外还含有O元素,所以不是烃,属于烃的含氧衍生物,故B错误;
C.含有碳碳双键,所以能和溴发生加成反应而使溴水褪色,故C正确;
D.根据结构简式知,其分子式为C10H18O,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烃的概念、烯烃及醇的性质,题目难度不大.

练习册系列答案
相关题目
19.下列实验操作、现象与实验结论一致的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | SO2通入Ba(NO3)2溶液中,有白色沉淀生成 | 发生复分解反应生成难溶物质BaSO3 |
| B | 某溶液滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中可能不含SO42- |
| C | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别 滴加CCl4,振荡,静置,下层分别呈无色和紫红色 | 氧化性:Fe3+>Br2>I2 |
| D | 向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴 加1~2滴0.01mol•L-1 AgNO3溶液,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
18.小华同学欲以过氧化氢(H2O2)的分解反应来探究影响化学反应速率的条件.
(1)表是小华的一组探究数据,请回答相关问题:
表:在不同条件下用10mL H2O2制取150mLO2所需的时间(秒)
①在设计探究方案时,小华都考虑了哪些影响反应速率的条件浓度、催化剂、温度
②从上述设计方案中,请任选一个,说明小华的探究结论:升高温度反应速率加快
(2)表是小华的又一组探究数据,请回答相关问题:
①本实验的反应原理是(用化学方程式表示)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②本实验的探究目的是催化积的表面积对反应速率的影响.
(1)表是小华的一组探究数据,请回答相关问题:
表:在不同条件下用10mL H2O2制取150mLO2所需的时间(秒)
 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| 有催化剂、不加热 | 10 | 25 | 60 | 120 |
②从上述设计方案中,请任选一个,说明小华的探究结论:升高温度反应速率加快
(2)表是小华的又一组探究数据,请回答相关问题:
| 实验操作 | MnO2状态 | 观察结果 | 反应所需时间 |
| 将MnO2加入5mL5%过氧化氢溶液中,不震荡 | 粉末状 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
②本实验的探究目的是催化积的表面积对反应速率的影响.
15.下列事实不能用勒夏特列原理解释的是( )
| A. | 溴水中有下列平衡Br2+H2O═HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 合成氨反应,N2(g)+3H2(g)═2NH3(g),△H<0,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,增大压强体系颜色变深 | |
| D. | SO2催化氧化成SO3的反应,往往需要使用催化剂 |
19.1mol某烃最多能和1molHCl发生加成反应,生成1mol氯代烷,1mol此氯代烷能和Cl2发生取代反应最多生成9molHCl,生成只含碳元素和氯元素的氯代烷,该烃可能是( )
| A. | CH3-CH═CH-CH2-CH3 | B. | CH2═CH-CH═CH2 | ||
| C. | CH3═CH-CH3 | D. | CH3-CH═CH-CH3 |
16.下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:通入氢气让乙烯充分反应;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
①除去乙烷中少量的乙烯:通入氢气让乙烯充分反应;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
17.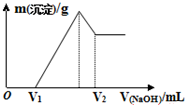 将0.1mol的镁、铝混合物溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.下列说法不正确的是( )
将0.1mol的镁、铝混合物溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.下列说法不正确的是( )
 将0.1mol的镁、铝混合物溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.下列说法不正确的是( )
将0.1mol的镁、铝混合物溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.下列说法不正确的是( )| A. | O~V1发生反应的离子方程式为:H++OH-═H2O | |
| B. | 当V1=160mL时,V2的体积为360mL | |
| C. | 当V1=160mL时,金属混合物中镁的质量为1.44g | |
| D. | 当Mg2+、Al3+刚好沉淀完全,则滴入的NaOH溶液的体积为400mL |

 甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验:
甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验: