题目内容
7.将下列离子:Al3+、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、NH4+、H+、AlO2-、CO32-按可能大量共存的情况,把它们全部分成A、B两组,而且每组中都含有不少于两种阳离子和两种阴离子.下列离子不会同在一组的是( )| A. | Na+、NO3- | B. | S2-、AlO2- | C. | Al3+、Fe3+ | D. | MnO4-、NH4+ |
分析 由给出的离子可知,与氢离子共存的一组,与氢氧根离子共存的一组,结合离子之间的反应分为两组,且每组中都含有不少于两种阳离子和两种阴离子,以此来解答.
解答 解:OH-、H+在溶液中不能大量共存,据此可以分为两组:$\left\{\begin{array}{l}{{H}^{+}}\\{O{H}^{-}}\end{array}\right.$,
Al3+、Fe3+、NH4+能够与OH-离子反应,只能与①H+离子一组;总共有6种阳离子,①H+离子组中已经含有4种,则剩余的2种阳离子Na+、K+只能存在②中;
CO32-、AlO2-能够与H+反应,只能与②OH-离子分在一组;
①H+离子一组含有的离子为:Al3+、Fe3+、NH4+、H+,
②OH-离子组含有的离子有:Na+、K+、CO32-、OH-、AlO2-,
剩余的阴离子为:S2-、MnO4-、NO3-,
由于①组中铁离子具有氧化性,能够氧化S2-,所以S2-,只能存在于②组,
MnO4-、NO3-只能存在于①组,
第一组有四种阳离子和两种阴离子,则含有的离子为Al3+、Fe3+、NH4+、H+、MnO4-、NO3-,
第二组有四种阴离子和两种阳离子,含有的离子有:Na+、K+、CO32-、OH-、AlO2-、S2-,
显然Na+、NO3-不会同在一组,
故选A.
点评 本题考查常见离子的检验,为高频考点,把握离子之间的反应、离子个数为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
6.反应A(g)+2B(g)?C(g)+D(g)+QKJ的能量变化如图所示,有关叙述正确的是( )
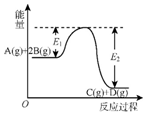

| A. | Q=E2 | |
| B. | 在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 | |
| C. | Q>0,升高温度,正反应速率增大,逆反应速率减小 | |
| D. | 若减小体积,平衡会移动,当反应再次达到平衡时,A的平衡浓度增大 |
3.滴定管中的液面如图所示,此时的读数为( )


| A. | 12.10mL | B. | 12.00mL | C. | 11.90mL | D. | 11.80mL |
19.室温下pH值相同的下列溶液中,浓度最大的是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | NaOH | D. | CH3COONa |
16.下列关于物质的检验,说法正确的是( )
| A. | 向无色溶液中加入氯化钡溶液有白色沉淀生成,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 滴加硝酸化的AgNO3溶液后产生白色沉淀,说明该溶液一定含有Cl- | |
| D. | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
17.下列离子或分子能够在指定的分散系中大量共存的是( )
| A. | 空气中:CO2、NO、N2、NH3 | |
| B. | 明矾溶液中:H+、Mg2+、Na+、Cl- | |
| C. | 过量铁与稀硝酸反应后的溶液中:H+、Cl-、I-、Na+ | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:NH4+、Na+、Cl-、CO32- |

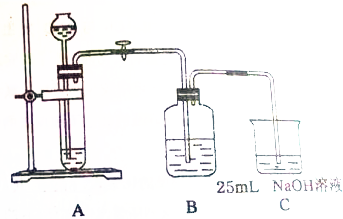 某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:
某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤: