题目内容
3.写出图中序号①~④仪器的名称:
(1)①蒸馏烧瓶;②冷凝管;③分液漏斗;④容量瓶;
(2)除去粗盐中的泥沙应选择装置Ⅳ,操作名称过滤.
(3)分离水和汽油的混合物应选择装置Ⅱ,操作名称分液.
(4)除去淀粉溶液中的NaCl应选择装置Ⅴ,操作名称渗析.
(5)除去酒精溶液中的水应选择装置Ⅰ,操作名称容量瓶.
分析 (1)根据仪器图形可确定仪器偏、名称;
(2)泥沙不溶于水,可用过滤的方法除去;
(3)水和汽油分层;
(4)淀粉不能透过半透膜;
(5)酒精和水的沸点不同.
解答 解:(1)由仪器图形可可知①为蒸馏烧瓶,②为冷凝管,③为分液漏斗,④为容量瓶,故答案为:蒸馏烧瓶;冷凝管;分液漏斗;容量瓶;
(2)泥沙不溶于水,可用过滤的方法除去,应用Ⅳ装置,故答案为:Ⅳ;过滤;
(3)水和汽油分层,可用Ⅱ装置分液的方法分离,故答案为:Ⅱ;分液;
(4)淀粉不能透过半透膜,可用渗析的方法分离,装置为Ⅴ,故答案为:Ⅴ;渗析;
(5)酒精和水的沸点不同,可用蒸馏的方法分离,装置为Ⅰ,故答案为:Ⅰ;蒸馏.
点评 本题考查物质的分离提纯操作,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意把握常见仪器的使用.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
13.某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题.(有关实验药品为:市售食用白醋样品500mL、0.1000mol/L NaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液.)
Ⅰ.实验步骤:
(1)用滴定管吸取10mL市售白醋样品,配成100mL的溶液.
(2)用酸式滴定管取待测食醋溶液20.00mL于锥形瓶中.
(3)用碱式滴定管盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
则样品中醋酸的浓度c=0.75mol/L,其含量为4.5g/100mL.(写出计算过程)
Ⅰ.实验步骤:
(1)用滴定管吸取10mL市售白醋样品,配成100mL的溶液.
(2)用酸式滴定管取待测食醋溶液20.00mL于锥形瓶中.
(3)用碱式滴定管盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
14.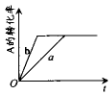 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是 ( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是 ( )
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是 ( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是 ( )| A. | 增大A的浓度或减少C的浓度 | |
| B. | 缩小容器的容积或加入催化剂 | |
| C. | 升高温度或增大压强 | |
| D. | 由a变成b,A和B的物质的量与C、D的物质的量相等 |
11.下列说法中正确的是( )
| A. | 同温同压下,相同体积的物质,它们的物质的量必相等 | |
| B. | 1 L一氧化碳气体一定比1 L氧气的质量小 | |
| C. | 28 g N2和CO的混合气体在标准状况下的体积约为22.4 L | |
| D. | 常温常压下,1 mol碳完全燃烧消耗22.4 L氧气 |
18.化学实验要注意安全,下列实验操作和事故的处理方法中,正确的是( )
| A. | 浓硝酸不小心沾到皮肤上,立即用NaOH溶液洗涤 | |
| B. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| C. | 碱溶液沾到皮肤上,立即用浓酸中和并冲洗 | |
| D. | 配制硫酸溶液时,先在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸 |
8.唐山市曹妃甸区10月20日的空气质量日报如表:
下列情况对表中三个空气质量指标不会产生影响的是( )
| 项目 | 空气污染指数 | 空气质量级别 | 空气质量 |
| 可吸入颗粒物 | 65 | Ⅱ | 良 |
| 二氧化硫 | 6 | ||
| 二氧化氮 | 20 |
| A. | 用氢气作燃料 | B. | 露天焚烧垃圾 | ||
| C. | 大量排放汽车尾气 | D. | 用煤作燃料 |
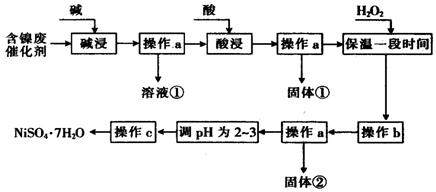
15.某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
部分阳离子以氢氧化物形式沉淀时的pH如表:
(1)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2≤PH<7.1.

部分阳离子以氢氧化物形式沉淀时的pH如表:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2≤PH<7.1.
12.既能用浓硫酸干燥又能用碱石灰干燥的气体是( )
| A. | Cl2 | B. | CO2 | C. | O2 | D. | NH3 |
14.工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在同温度下反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.数据如下:
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量小于(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量.
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数K=1.
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=4/Vt1mol/(L•min)
(5)已知:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,
写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)﹦2CO2(g)△H=-566 kJ/mol.
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在同温度下反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数K=1.
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=4/Vt1mol/(L•min)
(5)已知:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,
写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)﹦2CO2(g)△H=-566 kJ/mol.