题目内容
11.下列说法中正确的是( )| A. | 同温同压下,相同体积的物质,它们的物质的量必相等 | |
| B. | 1 L一氧化碳气体一定比1 L氧气的质量小 | |
| C. | 28 g N2和CO的混合气体在标准状况下的体积约为22.4 L | |
| D. | 常温常压下,1 mol碳完全燃烧消耗22.4 L氧气 |
分析 A.必须指出物质的状态为气体,否则该关系不成立;
B.没有指出相同条件下,无法判断二者物质的量大小;
C.标准状况下气体摩尔体积约为22.4L/mol,根据V=nVm计算;
D.常温常压下,不能使用标准状况下的气体摩尔体积计算.
解答 解:A.同温同压下,相同体积的气体,它们的物质的量必相等,物质状态必须为气态,故A错误;
B.缺少条件,无法比较一氧化碳和氧气的物质的量大小,故B错误;
C.N2和CO的摩尔质量都是28g/mol,28 g N2和CO的混合气体的物质的量为1mol,在标准状况下的体积约为22.4 L/mol×1mol=22.4L,故C正确;
D.1 mol碳完全燃烧消耗1mol氧气,1mol氧气在常温常压下的体积大于22.4L,故D错误;
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确气体摩尔体积的使用条件为解答关键,注意掌握物质的量与其它物理量之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
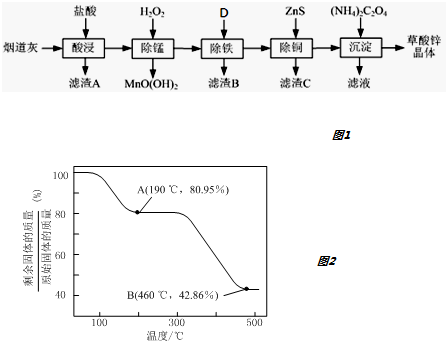
1.以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4•2H2O).如图1
有关氢氧化物开始沉淀和沉淀完全的pH如表:
请问答下列问题:
(1)滤渣A的主要成分为SiO2.为了提高浸出速率,除将烟道灰处理得更细外,还可采取的措施有适当增加盐酸的浓度、提高反应温度、搅拌(写出两条).
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入的物质D最好是ZnO或ZnCO3或Zn(OH)2.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是将Na2C2O4缓慢加入到ZnCl2溶液中,边加边搅拌.
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图2所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.

有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2.为了提高浸出速率,除将烟道灰处理得更细外,还可采取的措施有适当增加盐酸的浓度、提高反应温度、搅拌(写出两条).
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入的物质D最好是ZnO或ZnCO3或Zn(OH)2.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是将Na2C2O4缓慢加入到ZnCl2溶液中,边加边搅拌.
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图2所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.
2.一定浓度的下列溶液,不外加任何试剂就能依次鉴别出来,正确的鉴别顺序为( )
①NaOH溶液 ②(NH4)2SO4溶液 ③BaCl2溶液 ④KNO3溶液 ⑤FeCl3溶液.
①NaOH溶液 ②(NH4)2SO4溶液 ③BaCl2溶液 ④KNO3溶液 ⑤FeCl3溶液.
| A. | ①②③④⑤ | B. | ②③⑤④① | C. | ⑤①②③④ | D. | ⑤③②①④ |
19.下面有关氧化还原反应的叙述正确的是( )
| A. | 在反应中不一定所有元素的化合价都发生变化 | |
| B. | 肯定有一种元素被氧化,另一种元素被还原 | |
| C. | 非金属单质在反应中只做氧化剂 | |
| D. | 某元素从化合物变为单质时,该元素一定被还原 |
16.需要加入氧化剂才能实现的变化是( )
| A. | MnO2→MnSO4 | B. | KI→KIO3 | C. | HNO 3→NO | D. | Al2O 3→Al(OH)3 |
2.某兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,用0.1000mol•L-1标准盐酸润洗2~3次后,再向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点时,记下读数.
④再进行两次滴定,记下读数.
试回答下列问题:
(1)该小组在步骤①中的错误操作是用待测液润洗锥形瓶_,由此造成的测定结果偏高(填“偏高”、“偏低”或“无影响”).
(2)步骤②中酸式滴定管用标准酸液润洗2~3次的目的是确保标准盐酸溶液的浓度不发生变化.
(3)步骤③中滴定终点如何判断:锥形瓶内溶液由红色变为无色,且半分钟内颜色不再改变.
(4)该小组同学所做三次平行实验的数据记录如下:
请计算所测烧碱溶液的浓度为0.1250mol•L-1.
①将碱式滴定管用蒸馏水洗净,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,用0.1000mol•L-1标准盐酸润洗2~3次后,再向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点时,记下读数.
④再进行两次滴定,记下读数.
试回答下列问题:
(1)该小组在步骤①中的错误操作是用待测液润洗锥形瓶_,由此造成的测定结果偏高(填“偏高”、“偏低”或“无影响”).
(2)步骤②中酸式滴定管用标准酸液润洗2~3次的目的是确保标准盐酸溶液的浓度不发生变化.
(3)步骤③中滴定终点如何判断:锥形瓶内溶液由红色变为无色,且半分钟内颜色不再改变.
(4)该小组同学所做三次平行实验的数据记录如下:
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第1次 | 20.00 | 4.10 | 29.10 |
| 第2次 | 20.00 | 0.00 | 24.90 |
| 第3次 | 20.00 | 4.00 | 29.10 |
