题目内容
13.某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题.(有关实验药品为:市售食用白醋样品500mL、0.1000mol/L NaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液.)Ⅰ.实验步骤:
(1)用滴定管吸取10mL市售白醋样品,配成100mL的溶液.
(2)用酸式滴定管取待测食醋溶液20.00mL于锥形瓶中.
(3)用碱式滴定管盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
分析 Ⅰ.滴定时,氢氧化钠溶液放在碱式滴定管中,待测液放在锥形瓶中;
Ⅱ.分析图表数据结合醋酸和氢氧化钠按照1:1反应计算样品溶液浓度,依据浓度计算样品总酸量.
解答 解:Ⅰ.(2)用酸式滴定管取待测食醋溶液20.00mL于锥形瓶中,故答案为:锥形瓶;
(3)氢氧化钠可腐蚀玻璃塞,应放在碱式滴定管中,故答案为:碱式滴定管;
Ⅱ.依据实验数据结合反应CH3COOH+NaOH=CH3COONa+H2O,实验4误差较大,可舍去,
实验1、2、3平均消耗氢氧化钠溶液体积=$\frac{14.98+15.00+15.02}{3}$=15.00ml;
c(样品)×V(样品)=c(NaOH)×V(NaOH)
c(样品)×20.00ml=0.1000mol/L×15.00ml
c(样品)=0.75mol/L;
样品总酸量g/100mL=$\frac{0.75mol×60g/mol}{1000ml}$=4.5g/100ml,
故答案为:0.75mo/L;4.5.
点评 本题考查物质的含量的测定,为高频考点和常见题型,题目侧重考查酸碱中和滴定实验的操作步骤和计算应用,注意把握终点判断,指示剂的选择,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
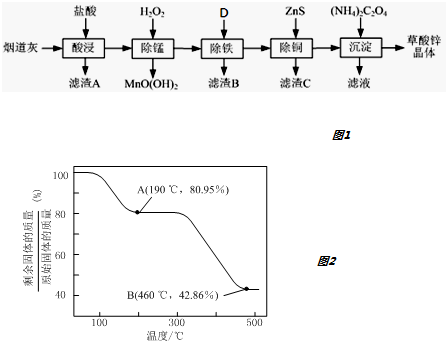
1.以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4•2H2O).如图1
有关氢氧化物开始沉淀和沉淀完全的pH如表:
请问答下列问题:
(1)滤渣A的主要成分为SiO2.为了提高浸出速率,除将烟道灰处理得更细外,还可采取的措施有适当增加盐酸的浓度、提高反应温度、搅拌(写出两条).
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入的物质D最好是ZnO或ZnCO3或Zn(OH)2.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是将Na2C2O4缓慢加入到ZnCl2溶液中,边加边搅拌.
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图2所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.

有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2.为了提高浸出速率,除将烟道灰处理得更细外,还可采取的措施有适当增加盐酸的浓度、提高反应温度、搅拌(写出两条).
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入的物质D最好是ZnO或ZnCO3或Zn(OH)2.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是将Na2C2O4缓慢加入到ZnCl2溶液中,边加边搅拌.
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图2所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.
18.关于焰色反应实验,说法错误的是( )
| A. | 做焰色反应实验用的铂丝要用受热容易挥发的稀盐酸洗涤 | |
| B. | 观察K2SO4的焰色应透过蓝色的钴玻璃 | |
| C. | 可以用焰色反应来区别NaCl溶液和KCl溶液 | |
| D. | 焰色反应一定是化学变化 |
5.分类是化学学习与研究的常用方法,下列分类正确的是( )
①硫酸、烧碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③Na2O、Fe2O3、A12O3属于碱性氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物
⑦根据溶液导电能力强弱,将电解质分为强电解质、弱电解质.
①硫酸、烧碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③Na2O、Fe2O3、A12O3属于碱性氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物
⑦根据溶液导电能力强弱,将电解质分为强电解质、弱电解质.
| A. | 只有②④⑥⑦ | B. | 只有①③⑤⑦ | C. | 只有③④⑥ | D. | 只有①②⑤ |
2.一定浓度的下列溶液,不外加任何试剂就能依次鉴别出来,正确的鉴别顺序为( )
①NaOH溶液 ②(NH4)2SO4溶液 ③BaCl2溶液 ④KNO3溶液 ⑤FeCl3溶液.
①NaOH溶液 ②(NH4)2SO4溶液 ③BaCl2溶液 ④KNO3溶液 ⑤FeCl3溶液.
| A. | ①②③④⑤ | B. | ②③⑤④① | C. | ⑤①②③④ | D. | ⑤③②①④ |
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.