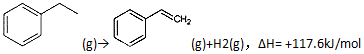题目内容
16.下列操作过程中使溶液导电性变化较大的是 ( )| A. | 100ml 0.1mol/L的氯水中通入0.01molSO2气体 | |
| B. | 100ml 0.5mol/L的NaOH中通入0.005mol氯气 | |
| C. | 100ml 0.5mol/L的CuSO4溶液中加入4g NaOH固体 | |
| D. | 100ml自来水中加入0.01mol蔗糖溶解 |
分析 溶液的导电性与离子浓度成正比,与电荷成正比,能使溶液导电性变化较大,说明操作前后溶液中离子浓度变化较大,据此分析解答.
解答 解:A.氯水中HClO是强电解质、HCl是强电解质,且氯气的溶解性较小,所以0.1mol/L的氯水中溶液的导电性较弱,通入0.01mol二氧化硫后,氯气、水和二氧化硫发生氧化还原反应生成盐酸和硫酸,离子浓度变化较大,溶液导电性变化较大,故A正确;
B.NaOH是强电解质,100ml 0.5mol/L的NaOH中通入0.005mol氯气,二者反应后溶液中溶质为NaCl、NaClO、NaOH,离子浓度变化不大,溶液导电性变化不大,故B错误;
C.n(NaOH)=$\frac{4g}{40g/mol}$=0.1mol,二者完全反应生成氢氧化铜和硫酸钠,离子浓度变化不大,溶液导电性变化不大,故C错误;
D.蔗糖是分子晶体,溶于水后以分子存在,所以自来水中离子浓度变化不大,则溶液导电性变化不大,故D错误;
故选A.
点评 本题考查电解质溶液导电性强弱判断,为高频考点,明确离子浓度、离子所带电荷是影响溶液导电性主要原因是解本题关键,知道物质之间发生的反应及强弱电解质,题目难度不大.

练习册系列答案
相关题目
12.用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 1 mol/L CaCl2溶液中含有Cl-的数目为NA | |
| B. | 标准状况下,2.24L HF所含分子数一定为0.1NA | |
| C. | 6.4g S6与S8的混合物中所含S原子数一定为0.2NA | |
| D. | 标准状况下,2.24L 氧元素的单质所含原子数一定为0.2NA |
4.CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如表:
(1)开展实验1和实验2的目的是研究温度对该化学平衡的影响.
(2)180℃时,反应到40min,体系是(填“是”或“否”)达到平衡状态,理由是温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态;CH4的平衡转化率为70%.
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值.(写出计算过程)
(4)已知CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1,求算:△H2=-1160kJ/mol.
| 实验编号 | 温度 | 0 | 10 | 20 | 40 | 50 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
(2)180℃时,反应到40min,体系是(填“是”或“否”)达到平衡状态,理由是温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态;CH4的平衡转化率为70%.
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值.(写出计算过程)
(4)已知CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1,求算:△H2=-1160kJ/mol.
11.由于少数不法商贩惟利是图,假酒、假盐、假药等引起的中毒事件屡有发生.下列物质被误食后,不会引起中毒的是( )
| A. | NaNO2 | B. | AgNO3 | C. | BaCO3 | D. | BaSO4 |
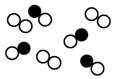
1.请根据所给图形回答下列问题:
(1)图表示容器中气体粒子的示意图,图中“○”和“●”分别代表不同元素的原子,它们的结合体代表分子,则图中可表示氮气的是D,可表示氯化氢(HCl)分子的是B,可表示一氧化碳和氧气的混合气体的是C(填序号).
(2)如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是C(填序号).
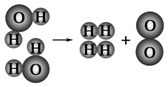
A.生成1mol O2需断开4mol H-O共价键
B.水分解后生成氢气和氧气的分子数比为2:1
C.水分解过程中,分子的种类不变
D.水分解过程中,原子的数目不变
(3)表各图中的小球代表原子序数从1~18元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键.下列各图表示的结构与化学式一定不相符的是C(填序号).
(1)图表示容器中气体粒子的示意图,图中“○”和“●”分别代表不同元素的原子,它们的结合体代表分子,则图中可表示氮气的是D,可表示氯化氢(HCl)分子的是B,可表示一氧化碳和氧气的混合气体的是C(填序号).
 |  |  |  |
| A | B | C | D |

A.生成1mol O2需断开4mol H-O共价键
B.水分解后生成氢气和氧气的分子数比为2:1
C.水分解过程中,分子的种类不变
D.水分解过程中,原子的数目不变
(3)表各图中的小球代表原子序数从1~18元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键.下列各图表示的结构与化学式一定不相符的是C(填序号).
| A | B | C |
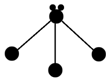 |  | 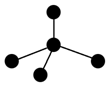 |
| NH3 | CO2 | CCl4 |
6.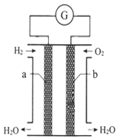 氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )
氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )
 氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )
氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )| A. | 在电池反应中每转移2mol电子,正极消耗O2的体积为11.2L | |
| B. | b极的电极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 工作一段时间后,电解质溶液碱性减弱 | |
| D. | 该装置将化学能转化为电能 |